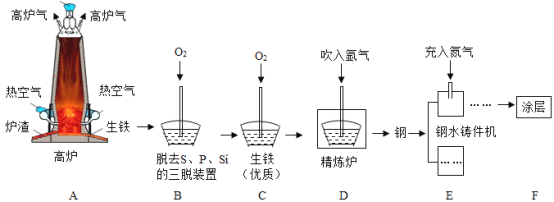
题目内容
【题目】如图是取大小形状相同的Mg、Zn、Fe、Cu四种金属与相同浓度的稀盐酸反应状况的示意图.仔细观察并结合所学的知识回答下列问题:

(1)不能与稀盐酸反应的金属是__________.
(2)图中显示有三种金属能与稀盐酸反应,其共同的反应现象是___________,其中反应速率最快的是__________,请写出它与盐酸反应的化学方程式是_____________.
(3)通过以上实验(或图示)说明,Zn和Cu的金属活动性强弱是___________.
(4)某兴趣小组的同学为了探究哪些因素可以影响金属与酸溶液反应的速率设计并进行了如下实验:
序号 | 实验过程 | 实验现象 |
① | 锌粉和铁粉分别与10%______反应 | 锌粉产生气体的速率快 |
② | 铁粉和铁片分别与10%盐酸反应 | _____产生气体的速率快 |
③ | 铁片分别与5%和10%盐酸反应 | 10%盐酸产生气体的速率____ |
(5)通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种____________.此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越_____________(填“快”或“慢”).
【答案】铜 有气泡产生 镁 Mg+2HCl=MgCl2+H2↑ 锌大于铜 盐酸 铁粉 快 金属的性质或种类、酸溶液的浓度、金属与酸溶液的接触面积等 快
【解析】
(1)由四种金属与盐酸反应状况的示意图可知,没有气泡生成的金属是铜,说明了不能与盐酸反应的金属是Cu;
(2)由四种金属与盐酸反应状况的示意图可知,有三种金属能与盐酸反应,其共同的反应现象是产生气泡;由四种金属与盐酸反应状况的示意图可知,产生气泡最快的就是反应速率最快的,是镁;镁与稀盐酸反应生成氯化镁和氢气,反应的化学方程式为:Mg+2HCl=MgCl2+H2↑;
(3)由四种金属与盐酸反应状况的示意图可知,铜不能与酸反应金属活动性最弱,镁与酸反应产生的气泡最多,镁最活泼,其次是锌,产生的气泡最慢的是铁,所以,四种金属的金属活动性由强到弱的顺序为Mg>Zn>Fe>Cu.
(4)①探究哪些因素可以影响金属与酸溶液反应的速率,所以实验中用的酸种类要相同,故填盐酸。②药品的接触面积越大反应速率越大,故铁粉快。③反应物的浓度越大,反应的速率越大,故填快;温度越高,反应速率越快.
故答案为:(1)铜;(2)有气泡产生;镁;Mg+2HCl=MgCl2+H2↑;
(3)锌大于铜;(4)盐酸;铁粉;快;(5)金属的性质或种类、酸溶液的浓度、金属与酸溶液的接触面积等;快.

【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | m | 0.04 | 0.02 |
试求:
(1)m的数值_____。
(2)此黄铜样品中铜的质量分数是少?_____(写出计算过程)