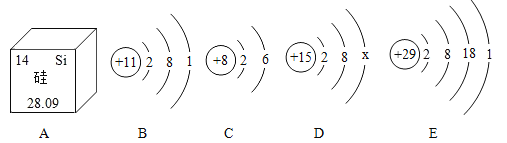题目内容
【题目】化学以实验为基础,水在化学实验中的作用不可忽视。下图中五个实验都用到水。
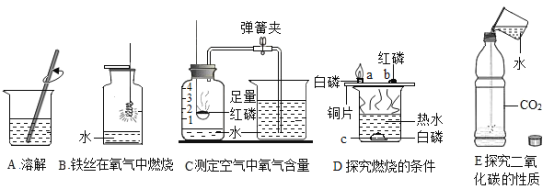
(1)实验 B 中水的作用是_____。
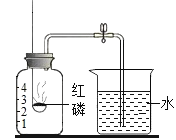
(2)实验 C 中红磷燃烧反应的化学方程式是_____;通过烧杯中的水进入集气瓶中的体积可得出氧气约占空气总体积 _____的结论。
(3)实验 D 中水的作用是提供热量和_____。
(4)实验 E 中的水发生的反应的化学方程式是_____。
【答案】防止高温生成物溅落,炸裂瓶底 4P+5O2![]() 2P2O5 1/5 隔绝氧气(空气) CO2+H2O═H2CO3
2P2O5 1/5 隔绝氧气(空气) CO2+H2O═H2CO3
【解析】
(1)铁丝燃烧的生成物温度很高,为了防止高温生成物溅落,炸裂瓶底,需在集气瓶内加少量水;故填:防止高温生成物溅落,炸裂瓶底;
(2)磷与氧气在点燃的条件下反应生成五氧化二磷;待红磷熄灭并冷却后,打开弹簧夹,观察到烧杯中的水进入集气瓶,瓶内水面最终上升约至1刻度处,由此可知氧气约占空气总体积的五分之一;故填:4P+5O2![]() 2P2O5;1/5;
2P2O5;1/5;
(3)实验 D 中水是用来隔绝空气并且加热红磷和白磷;故填:隔绝空气;
(4)二氧化碳溶于水生成碳酸,其化学方程式为:CO2+H2O═H2CO3;故填:CO2+H2O═H2CO3.

 名校课堂系列答案
名校课堂系列答案【题目】如图是取大小形状相同的Mg、Zn、Fe、Cu四种金属与相同浓度的稀盐酸反应状况的示意图.仔细观察并结合所学的知识回答下列问题:

(1)不能与稀盐酸反应的金属是__________.
(2)图中显示有三种金属能与稀盐酸反应,其共同的反应现象是___________,其中反应速率最快的是__________,请写出它与盐酸反应的化学方程式是_____________.
(3)通过以上实验(或图示)说明,Zn和Cu的金属活动性强弱是___________.
(4)某兴趣小组的同学为了探究哪些因素可以影响金属与酸溶液反应的速率设计并进行了如下实验:
序号 | 实验过程 | 实验现象 |
① | 锌粉和铁粉分别与10%______反应 | 锌粉产生气体的速率快 |
② | 铁粉和铁片分别与10%盐酸反应 | _____产生气体的速率快 |
③ | 铁片分别与5%和10%盐酸反应 | 10%盐酸产生气体的速率____ |
(5)通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种____________.此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越_____________(填“快”或“慢”).