题目内容
【题目】结合有关实验,回答下列问题:
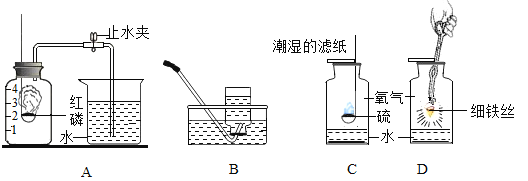
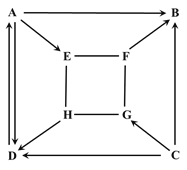
(1)用A实验验证空气中氧气的含量,能得到的正确结论是_____
(2)用B装置收集氧气时,得到的气体不纯,造成这种后果的原因可能是_____
(3)C实验中潮湿的滤纸和水的作用是_____
(4)图D是电解水的实验装置。实验中.试管甲中产生的气体是_____(填名称)它连接的是电源的_____极,当水分子分解时,生成氢原子和_____, 每两个氢原子结合成一个_____下列还能确认水是由氧元素和氢元素组成的实验是_____(填序号)。
A 氢气在氯气中燃烧
B 水的蒸发
C 氢气在氧气中燃烧
【答案】氧气约占空气体积的五分之一 集气瓶中未灌满水或反应刚产生气泡时就开始收集 吸收二氧化硫,防止二氧化硫污染空气 氢气 负 氧原子 氢分子 C
【解析】
(1)用A实验验证空气中氧气的含量,能得到的正确结论是氧气约占空气体积的五分之一;
(2)用B装置收集氧气时,得到的气体不纯,造成这种后果的原因可能是集气瓶中未灌满水或反应刚产生气泡时就开始收集;
(3)C实验中潮湿的滤纸和水的作用是吸收二氧化硫,防止二氧化硫污染空气;
(4)电解水实验的结论为“正氧负氢、氢二氧一”,图D电解水的实验装置中,试管甲中产生的气体是氢气,与它连接的是电源的负极,当水分子分解时,生成氢原子和氧原子, 每两个氢原子结合成一个氢分子。
氢气在氧气中燃烧也能说明水是由氧元素和氢元素组成,故选C。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】如图是取大小形状相同的Mg、Zn、Fe、Cu四种金属与相同浓度的稀盐酸反应状况的示意图.仔细观察并结合所学的知识回答下列问题:

(1)不能与稀盐酸反应的金属是__________.
(2)图中显示有三种金属能与稀盐酸反应,其共同的反应现象是___________,其中反应速率最快的是__________,请写出它与盐酸反应的化学方程式是_____________.
(3)通过以上实验(或图示)说明,Zn和Cu的金属活动性强弱是___________.
(4)某兴趣小组的同学为了探究哪些因素可以影响金属与酸溶液反应的速率设计并进行了如下实验:
序号 | 实验过程 | 实验现象 |
① | 锌粉和铁粉分别与10%______反应 | 锌粉产生气体的速率快 |
② | 铁粉和铁片分别与10%盐酸反应 | _____产生气体的速率快 |
③ | 铁片分别与5%和10%盐酸反应 | 10%盐酸产生气体的速率____ |
(5)通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种____________.此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越_____________(填“快”或“慢”).