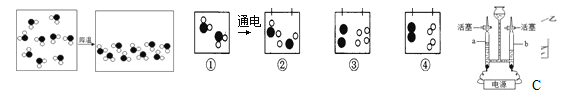
题目内容
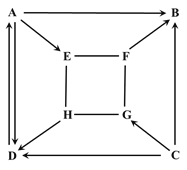
【题目】A、B是生活中常见的两种液态物,元素种类相差一种其中B可作燃料也可作汽车燃料添加剂;C和D为一种常见的黑色固体,其中C其相对分子质量为80。图中的“→”表示物质间转化,“一”表示相互之间能反应。
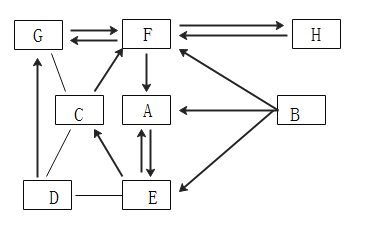
(1)B的化学式为_____。写出F转化成A的化学反应方程式_____,写出基本反应类型中G变成F的化学反应方程式:_____。
(2)以下说法正确的是(____)
①B转化成A的过程放出大量热,是化合反应
②H可以通过分解反应转化成F
③图中 ABCFGH均属于氧化物
④工业制取E的方法是物理变化,F可用于人工降雨
【答案】C2H5OH CO2 +Ca(OH)2 =CaCO3↓+ H2O(合理即可) 2CO+O2![]() 2CO2 ②④
2CO2 ②④
【解析】
A、B是生活中常见的两种液态物质,元素种类相差一种,其中B可作燃料也可作汽车燃料添加剂,A可能是水(H2O),B可能是乙醇(C2H5OH);C为一种常见的黑色固体,其中C的相对分子质量为80,C能转化为A(H2O),氧化铜(CuO)的相对分子质量=64+16=80,氧化铜与氢气在加热条件下能生成水,C可能为氧化铜;D为一种常见的黑色固体,D能与C(CuO)反应,碳为黑色固体,碳与氧化铜在高温条件下能生成铜和二氧化碳,D可能为碳;D能转化为G,G能与C(CuO)反应,碳在氧气中不完全燃烧能生成一氧化碳,一氧化碳能与氧化铜反应,G可能是一氧化碳;G与F能相互转化,且F能转化为A(H2O),一氧化碳在氧气中燃烧生成二氧化碳,二氧化碳与碳在高温条件下生在一氧化碳,二氧化碳与氢氧化钙能生成水和碳酸钙,F可能是二氧化碳;F能与H相互转化,二氧化碳与水反应生成碳酸,碳酸分解生成水和二氧化碳,H可能是碳酸;A (H2O)与E能相互转化,E能转化C(CuO),水通电分解生成氧气和氢气,氢气在氧气中燃烧生成水,铜与氧气能生成氧化铜,E可能是氧气。将猜想代入框图,猜想正确。
根据以上分析可知:
(1)B为乙醇(或酒精),化学式为C2H5OH;F转化成A的反应可以是二氧化碳与氢氧化钙能生成水和碳酸钙,化学反应方程式为:CO2 +Ca(OH)2 =CaCO3↓+ H2O;
基本反应类型中G变成F的反应是一氧化碳在氧气中燃烧生成二氧化碳,该反应是由两种物质生成一种物质的反应,属于化合反应,化学反应方程式:2CO+O2![]() 2CO2;
2CO2;
(2)①B转化成A的过程是酒精与氧气反应生成二氧化碳和水,放出大量热,但该反应的生成物是两种物质,不属于化合反应,故①错误;
②H转化成F可以通过碳酸分解生成水和二氧化碳,该反应属于分解反应,故②正确;
③图中A是水(H2O)、 B是乙醇(C2H5OH)、C可能为氧化铜、F是二氧化碳、G是一氧化碳、H可能是碳酸,其中B、H是由三种元素组成,不属于氧化物,故③错误;
④工业制取E(O2)的方法是利用氧气和氮气的沸点不同,分离过程中没有新物质生成,属于物理变化,F是二氧化碳,固体二氧化碳(干冰)易升华,可获得低温,可用于人工降雨,故④正确。故选②④。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】如下图(夹持仪器已略),某兴趣小组在老师指导下,探究铁与水蒸气的反应,请回答。
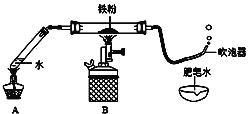
【实验初探】
(1)连接装置,并___________。
(2)装好药品。
(3)加热一段时间后,吹泡器连续吹出气泡,且气泡向上飞起,用燃着的木条靠近气泡,能产生爆鸣。
该气体燃烧的化学方程式为________。
【查阅资料】铁有三种氧化物(FeO、Fe2O3、Fe3O4)。
①它们都不溶于水,其中铁粉、Fe3O4能被磁铁吸引;②FeO接触到空气会立即由黑色变为红棕色;③三种氧化物都不与硫酸铜溶液反应,但能与酸反应生成可溶性物质。
【实验探究】实验小组同学对反应后的剩余固体进行探究。
(1)小梅发现固体为黑色,由此判断:固体中肯定不存在Fe2O3 ,理由是_______。
(2)小宇发现固体均能被磁铁吸引,大家倒出玻璃管中黑色固体,平铺于白纸上。观察现象是__________,判断黑色固体中一定没有FeO。
讨论:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
【提出猜想】玻璃管中黑色固体成分有什么?
猜想Ⅰ:Fe; 猜想Ⅱ:Fe3O4; 猜想Ⅲ:______________
实验步骤 | 实验现象 | 实验结论 |
取上述固体少许,加入足量 _________________ | 出现红色固体,且有黑色固体残留 | 黑色固体中一定含有 ________________ |
【结论反思】(1)铁与水蒸气发生置换反应,反应的方程式是________________。
(2)出现红色固体的化学方程式是_______,加入的溶液必须足量的原因是______________。
【题目】如图是取大小形状相同的Mg、Zn、Fe、Cu四种金属与相同浓度的稀盐酸反应状况的示意图.仔细观察并结合所学的知识回答下列问题:

(1)不能与稀盐酸反应的金属是__________.
(2)图中显示有三种金属能与稀盐酸反应,其共同的反应现象是___________,其中反应速率最快的是__________,请写出它与盐酸反应的化学方程式是_____________.
(3)通过以上实验(或图示)说明,Zn和Cu的金属活动性强弱是___________.
(4)某兴趣小组的同学为了探究哪些因素可以影响金属与酸溶液反应的速率设计并进行了如下实验:
序号 | 实验过程 | 实验现象 |
① | 锌粉和铁粉分别与10%______反应 | 锌粉产生气体的速率快 |
② | 铁粉和铁片分别与10%盐酸反应 | _____产生气体的速率快 |
③ | 铁片分别与5%和10%盐酸反应 | 10%盐酸产生气体的速率____ |
(5)通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种____________.此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越_____________(填“快”或“慢”).