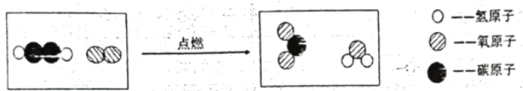
题目内容
【题目】图甲是锌元素在元素周期表中的相关信息,图乙是锌原子结构示意图,下列说法正确的是( )
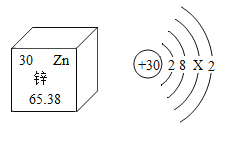
A. 图乙中X=8
B. 锌的原子序数为30
C. 锌的相对原子质量为65.38g
D. 锌原子在化学变化中容易得到电子
【答案】B
【解析】
根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量;原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。若最外层电子数>4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子。
A、质子数=核外电子数,为原子,则30=2+8+X+2,X=18,故选项说法错误。
B、根据元素周期表中的一格可知,左上角的数字为30,该元素的原子序数为30,故选项说法错正确。
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为65.38,相对原子质量单位是“1”,不是“克”,故选项说法错误。
D、锌原子的最外层电子数是2,在化学反应中易失去2个电子而形成阳离子,故选项说法错误。
故选:B。

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】氢化钙(CaH2)是一种白色细颗粒状固体,能与水发生剧烈反应,其反应的化学方程式为:![]() ,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是_____。为进一步确定滤液中所含溶质的成分,他们进行了以下实验探究。
,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是_____。为进一步确定滤液中所含溶质的成分,他们进行了以下实验探究。
[提出猜想]猜想一: NaOH
猜想二: NaOH 和Ca(OH)2
猜想三: NaOH、Na2CO3
猜想四: NaOH、 Na2CO3、 Ca(OH)2
经过讨论,大家一致认为猜想四不合理,理由是(用化学方程式表示)______。
[实验验证]
实验 | 现象 | 结论 |
(1)取少量滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想___不成立 |
(2)另取少量滤液,向其中加入______ | _____ | 猜想三成立 |
[反思与拓展]若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和___。