题目内容
【题目】乙炔(C2H2)在氧气中燃烧的微观示意图如下,下列说法正确的是
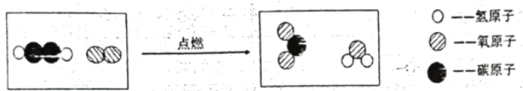
A.反应后氧原子个数增加了
B.lmol 乙炔中约含有![]() 个碳原子
个碳原子
C.反应前后氢元素的存在形态发生了变化
D.生成的两种分子的物质的量之比为2:1
【答案】D
【解析】
A、根据质量守恒定律,反应前后原子数目不变,选项A错误;
B、乙炔化学式为C2H2,所以1mol乙炔中含有12.04×1023个碳原子,选项B错误;
C、乙炔为气体,反应后生成水,也是以水蒸气的状态存在,所以反应前后氢元素存在形态未发生变化,选项C错误;
D、根据微观示意图可知,乙炔与氧气在点燃条件下反应生成水和二氧化碳,反应的化学方程式为 ,由此可以看出生成二氧化碳与水的物质的量之比为2:1,选项D正确。故选D。
,由此可以看出生成二氧化碳与水的物质的量之比为2:1,选项D正确。故选D。

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组的同学在做酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中加入一定量的稀盐酸后,发现忘了滴加酸碱指示剂,因此,他们停止滴加稀盐酸,并对烧杯中溶液的溶质成分进行探究。
[提出问题]该烧杯中溶液的溶质是什么?
[猜想与假设]同学们提出如下四种猜想:
猜想一:只有CaC l2;
猜想二:含有CaCl2和__;
猜想三:含有CaCl2和HCl;
猜想四:含有CaCl2、HCl和Ca(OH)2。
同学们经过讨论后一致认 为猜想_____不正确,理由是______。
[查阅资料]氯化钙溶液呈中性。
[进行实验]同学们设计了如下实验方案进行探究,请你帮他们填写有关实验步骤及实验现象。
实验方案 | 实验步骤 | 实验现象 |
方案一 | 取少量烧杯中的溶液于试管中,滴加几滴紫色石蕊溶液 | ______ |
方案二 | 取___于试管中,加入一定量的烧杯中的溶液 | 产生气泡 |
方案三 | 取少量烧杯中的溶液于另一只试管中,滴加适量的AgNO3溶液 | 产生白色沉淀 |
[得出结论]猜想三成立。方案二中发生反应的化学方程式为______。
[交流反思](1)老师看过他们的实验报告后指出,方案三不能证明猜想三成立。原因是____。
(2)为了保护环境,需将废液处理之后再排收,可以向烧杯中加入适量的________。
【题目】溶液与人们的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填字母).
A 高锰酸钾
B 汽油
C 面粉
(2)在盛有水的烧杯中加入以下物质,能使溶液温度升高的是____(填字母)。
A 烧碱
B 硝酸铵
C 氯化钠
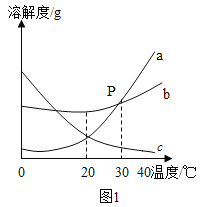
(3)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.9 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①60°C时,氯化钠的溶解度_______。
②表中某物质的饱和溶液随温度升高析出固体,该物质是____(填化学式)
③20°C时,氯化钠饱和溶液中溶质的质量分数为_____(结果保留至0.1%) .
④向20°C的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20°C,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量___ (填 “增大”“不变”或“减小”)。
⑤用_____的方法提纯混有少量氯化钠的硝酸钾固体.