题目内容
【题目】某炼铁废渣中含有大量CuS及少量的铁和铁的化合物(主要是氧化铁),工业上以该废渣为原料生产CuSO45H2O晶体的流程如图:
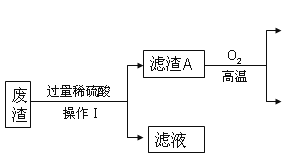
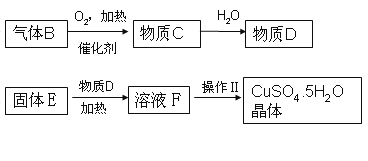
参考资料:CuS常温下和稀酸不发生反应。
(1)操作I的名称为_____,该过程中玻璃棒的作用是_____,由操作I得到的滤液中含有的溶质为_____。写出滤渣A和氧气反应的化学方程式_____。
(2)由固体E得到溶液F的过程通常需要加热,其作用是_____,写出该步反应化学方程式:_____。
(3)操作Ⅱ包括的步骤有加热浓缩、_____、过滤。上述过程中可以循环利用的物质是_____。
【答案】过滤 引流 硫酸亚铁、硫酸铁、硫酸 2CuS+3O2![]() 2CuO+2SO2 加快反应速率 CuO+H2SO4
2CuO+2SO2 加快反应速率 CuO+H2SO4![]() CuSO4+H2O 降温结晶 硫酸
CuSO4+H2O 降温结晶 硫酸
【解析】
(1)操作I的名称为过滤,该过程中玻璃棒的作用是引流,由操作I得到的滤液中含有的溶质为铁、氧化铁分别和硫酸反应生成的硫酸亚铁、硫酸铁,还有过量的硫酸;滤渣A是硫化铜,和氧气在高温条件下反应生成氧化铜和二氧化硫,反应的化学方程式:2CuS+3O2![]() 2CuO+2SO2;
2CuO+2SO2;
(2)由固体E得到溶液F的过程通常需要加热,其作用是加快反应速率;该步反应化学方程式 CuO+H2SO4![]() CuSO4+H2O;
CuSO4+H2O;
(3)操作Ⅱ包括的步骤有加热浓缩、降温结晶、过滤,上述过程中可以循环利用的物质是D(硫酸)。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某实验小组的同学在做酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中加入一定量的稀盐酸后,发现忘了滴加酸碱指示剂,因此,他们停止滴加稀盐酸,并对烧杯中溶液的溶质成分进行探究。
[提出问题]该烧杯中溶液的溶质是什么?
[猜想与假设]同学们提出如下四种猜想:
猜想一:只有CaC l2;
猜想二:含有CaCl2和__;
猜想三:含有CaCl2和HCl;
猜想四:含有CaCl2、HCl和Ca(OH)2。
同学们经过讨论后一致认 为猜想_____不正确,理由是______。
[查阅资料]氯化钙溶液呈中性。
[进行实验]同学们设计了如下实验方案进行探究,请你帮他们填写有关实验步骤及实验现象。
实验方案 | 实验步骤 | 实验现象 |
方案一 | 取少量烧杯中的溶液于试管中,滴加几滴紫色石蕊溶液 | ______ |
方案二 | 取___于试管中,加入一定量的烧杯中的溶液 | 产生气泡 |
方案三 | 取少量烧杯中的溶液于另一只试管中,滴加适量的AgNO3溶液 | 产生白色沉淀 |
[得出结论]猜想三成立。方案二中发生反应的化学方程式为______。
[交流反思](1)老师看过他们的实验报告后指出,方案三不能证明猜想三成立。原因是____。
(2)为了保护环境,需将废液处理之后再排收,可以向烧杯中加入适量的________。