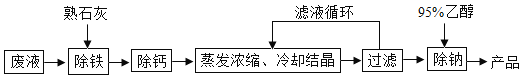
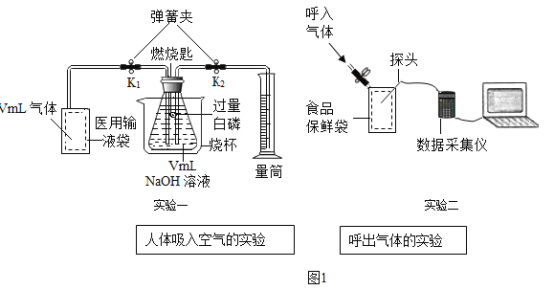
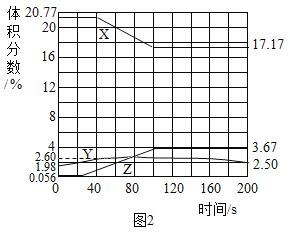
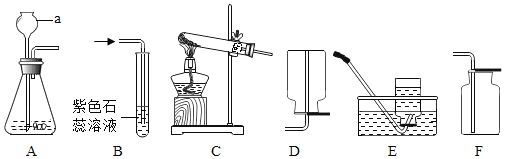
题目内容
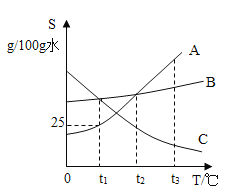
【题目】如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述正确的是( )
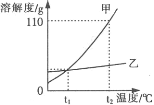
A. t2℃时,甲、乙两种溶液降温至tl℃均有固体析出时,所得甲、乙溶液溶质质量分数相等
B. 甲中混有少量乙,可用加热蒸发的方法提纯乙
C. tl℃时,甲、乙两种饱和溶液的溶质质量相等
D. t2℃时,用210 g甲的饱和溶液加水可以配制成500 g 20%的甲溶液
【答案】A
【解析】
A、t2℃时,甲、乙两种溶液降温至tl℃均有固体析出时,都属于饱和溶液,tl℃时甲、乙两物质的溶解度相等,故所得甲、乙溶液溶质质量分数相等,正确;
B、甲物质溶解度受温度影响变化较大,所以甲中混有少量乙,可用降温结晶的方法提纯乙,错误;
C、tl℃时,甲、乙两种饱和溶液的质量不能确定,所以饱和溶液的溶质质量不能确定,错误;
D、t2℃时,甲的溶解度为110g,用210 g甲的饱和溶液加水可以配制成500g溶质质量分数为:![]() ×100%=22%的甲溶液,错误。故选A。
×100%=22%的甲溶液,错误。故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
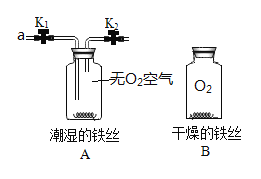
【题目】(6分)早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式
,盛水的铁锅与水面接触的一圈最易生锈。钢铁生锈的条件是 ,利用新技术能将不锈钢加工成柔软的金属丝,这是利用了不锈钢的 (填字母)。
A.耐腐蚀性 | B.延展性 | C.导热性 | D.导电性 |
(2)设计从废水中回收硫酸亚铁固体和铜的实验方案如下:

金属X是 ,
写出上述实验方案中有关反应的化学方程式
① ② 。