题目内容
【题目】某化学活动小组合作学习氢氧化钠和氢氧化钙的相关知识。如表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
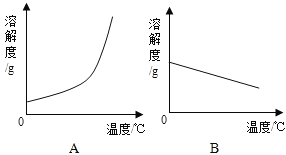
(1)依据上表数据,绘制了Ca(OH)2和NaOH的溶解度曲线,图中能表示NaOH溶解度曲线的是_____(填“A”或“B”)。
(2)将一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入适量氢氧化钙②升高温度③降低温度④加入水⑤蒸发水后再恢复到原温度⑥加入适量生石灰。
其中措施在原理上正确的是_____(填字母)
A ②④⑥ B ③④ C ①②⑤⑥ D ①②⑤
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH固体。这时溶液的质量分数为_____
(4)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH_____(填“偏大”或“偏小”“不受影响”)。
(5)可鉴别氢氧化钠溶液和澄清石灰水的一个化学反应方程式为_____。
【答案】A C 47.6% 偏小 CO2+Ca(OH)2=CaCO3↓+H2O
【解析】
(1)氢氧化钙的溶解度随温度的升高而减小,所以图中能表示NaOH溶解度曲线的是A;
(2)氢氧化钙的溶解度随温度的升高而减小,氧化钙和水反应生成氢氧化钙,所以将一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:①加入适量氢氧化钙、②升高温度、⑤蒸发水后再恢复到原温度、⑥加入适量生石灰,其中措施在原理上正确的是①②⑤⑥;
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH固体,氢氧化钠溶液仍是变化溶液,所以这时溶液的质量分数为:![]() ×100%=47.6%;
×100%=47.6%;
(4)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,溶液碱性减弱,再进行测定,则所测溶液的pH偏小;
(5)二氧化碳和氢氧化钠反应生成碳酸钠和水,没有明显现象;二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,生成白色沉淀,所以可鉴别氢氧化钠溶液和澄清石灰水的反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。

 发散思维新课堂系列答案
发散思维新课堂系列答案