��Ŀ����
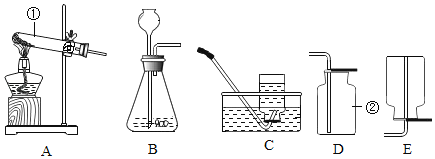
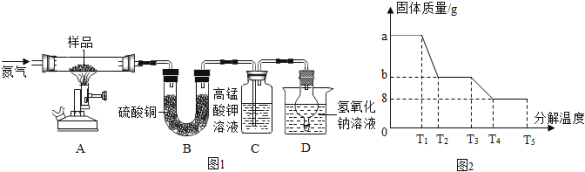
����Ŀ��ij��ѧʵ��С����̽�����ᡢ���������������ʵĻ�ѧ���ʣ�ȡ8֧�Թֱܷ���A��H��ź�������ʵ�顣
(1)ʵ���й۲쵽�����ݳ��ֵ��Թ���_____���г������ɵ��Թ���_____��
(2)д��ʵ��������������������Թ��з�����Ӧ�Ļ�ѧ����ʽ_____��
(3)ʵ���ij�Թ���Ϊ��ɫ��Һ���������м��������_____����Һ��Ϊ��ɫ���ɴ��ƶϣ����Թ������ʢ�е�������_____��
(4)ʵ���ij�Թܵĵײ��а�ɫ���壬���˺�����Һ�еμ�ϡ���ᣬһ��ʱ��������ݳ��֣������Һ�е�������_____��
(5)ʵ���ij�Թ���ֻ�õ���ɫ��Һ�������м���������Na2CO3��Һ�������������ɴ��ƶϣ����Թ������������Ӧ�Ļ�ѧ����ʽΪ_____��ԭ��ɫ��Һ�е�������_____��д�����п��ܣ���
���𰸡�BD GH Ca��OH��2+2HCl=CaCl2+2H2O ϡ���� ��ɫ��̪��Һ NaOH��Na2CO3 Na2CO3+2HCl=2NaCl+H2O+CO2�� NaCl��Na2CO3��NaCl
��������
��1��ϡ����������Ӧ�����������Ȼ�������ϡ������̼���Ʒ�Ӧ���ɶ�����̼������Ȼ��ƺ�ˮ�� ��ѡBD��
��2��ͼ������������ϡ�����ܷ�����Ӧ������������Ӧ�ķ���ʽΪ�� Ca��OH��2+2HCl=CaCl2+2H2O��
��3����̪������ʯ��ˮ��Ϊ��ɫ�������������ϡ�������Һ��Ϊ��ɫ����˵���Թ��е������Ƿ�̪��Һ��
��4��ʵ���ij�Թܵĵײ��а�ɫ���壬���˺�����Һ�еμ�ϡ���ᣬһ��ʱ��������ݳ��֣�˵���ó�����̼���γ�����������ϡ�����һ��ʱ���������ð������һ�����������ơ�����Һ��һ�������������ƺ�̼����
��5����������Ӧ�IJ����֪����̼���Ʋ���Ӧ����ҺΪ��ɫ��ֻ����ϡ������̼���Ʒ�Ӧ�������ķ�Ӧ������ɫ�ı仯��̼������ϡ���ᷴӦ�����Ȼ��ơ�������̼��ˮ����Ӧ�ķ���ʽΪ��Na2CO3+2HCl=2NaCl+H2O+CO2��������ɫ��Һ�е�����ֻ����̼���ƻ�̼�������Ȼ��ƵĻ���

����Ŀ��ij��ѧ�С�����ѧϰ�������ƺ��������Ƶ����֪ʶ�������Ca��OH��2��NaOH���ܽ�����ݡ���ش��������⣺
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 | |
�ܽ��/g | Ca��OH��2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
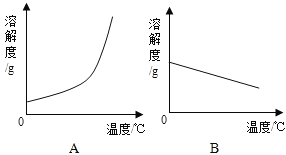
��1�������ϱ����ݣ�������Ca��OH��2��NaOH���ܽ�����ߣ�ͼ���ܱ�ʾNaOH�ܽ�����ߵ���_____���A����B������
��2����һƿ�ӽ����͵�Ca��OH��2��Һ��ɱ�����Һ�������ʩ�У�
�������������������������¶��������¶�������ˮ������ˮ���ٻָ���ԭ�¶�������������ʯ�ҡ�
���д�ʩ��ԭ������ȷ����_____������ĸ��
A �ڢܢ� B �ۢ� C �٢ڢݢ� D �٢ڢ�
��3��20��ʱ��191g����NaOH��Һ������10gˮ���ٻָ���20�棬������NaOH���塣��ʱ��Һ����������Ϊ_____
��4��20��ʱ�����ⶨNaOH��Һ��pH�����Ƚ�pH��ֽ������ˮ��ʪ���ٽ��вⶨ����������Һ��pH_____���ƫ��ƫС��������Ӱ�족����
��5���ɼ�������������Һ�ͳ���ʯ��ˮ��һ����ѧ��Ӧ����ʽΪ_____��