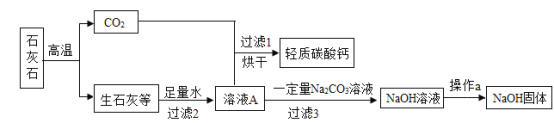
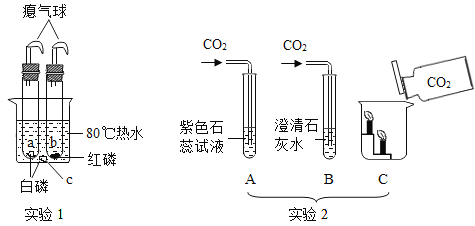
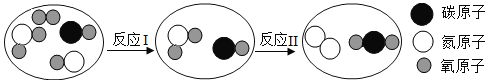
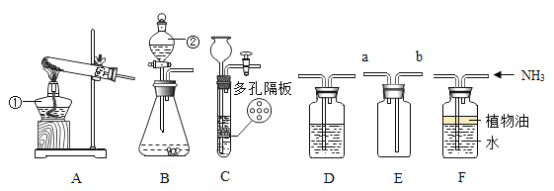
题目内容
【题目】在探究铝化学性质时发现铝与稀盐酸反应比与稀硫酸反应剧烈,化学兴趣小组进行了如下探究:
(1)铝与稀盐酸反应的化学方程式为_____。
(2)铝片使用前需要打磨的原因是_____,铝能被用来制作导线是因为其具有_____性。
(3)实验过程中,可以通过观察_____来比较铝与稀盐酸和稀硫酸反应的剧烈程度。
(4)(作出猜想)猜想一:Cl-对反应起了促进作用;
猜想二:SO![]() 对反应起了阻碍作用;
对反应起了阻碍作用;
猜想三:以上两种猜想同时成立。
(进行实验)
实验 | 实验操作 |
实验1 | 将铝片加入到10mLpH=1的稀盐酸中,然后向其中滴加CuSO4溶液 |
实验2 | 将铝片加入到10mLpH=1的稀硫酸中,然后向其中滴加浓盐酸 |
实验3 | 将铝片加入到10mLpH=1的稀盐酸中,然后向其中滴加Na2SO4溶液 |
(分析并得出结论)
①同学们认为实验1不可行,理由是_____。
②同学们认为实验2思路不正确,改进的方法是_____。
③实验3没有明显现象,证明猜想_____不成立。
【答案】2Al+6HCl=2AlCl3+3H2↑ 除去铝表面致密的氧化膜 导电 产生气泡的快慢 金属铝会与硫酸铜发生反应 浓盐酸换成氯化钠溶液 二、三
【解析】
(1)铝和盐酸反应生成氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑;
(2)铝容易被氧气氧化生成致密的氧化铝保护膜,所以铝片使用前需要打磨,原因是除去铝表面的致密的保护膜,铝能被用来制作导线是因为其具有导电性;
(3)根据可以通过观察产生气泡的快慢来比较铝与稀盐酸和稀硫酸反应的剧烈程度;
分析并得出结论:
①铝和硫酸铜也会反应,所以不能用实验1来验证硫酸根离子对反应的影响;
②氯化钠溶液中含有氯离子,而盐酸也和铝反应,所以实验2思路不正确,改进的方法是:浓盐酸换成氯化钠;
③加入硫酸钠溶液没有明显的现象,说明SO![]() 对反应没有起阻碍作用,所以猜想二、三不成立。
对反应没有起阻碍作用,所以猜想二、三不成立。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
(1)20℃时,NaCl的溶解度是__g.
(2)60℃时,
(3)根据表内数据可知,KNO3和NaCl溶解度相等的温度取值范围是__(填编号).
A 10℃~20℃之间 B 20℃~30℃之间
C 30℃~40℃之间 D 40℃~50℃之间.