题目内容
【题目】某同学在实验室以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠。
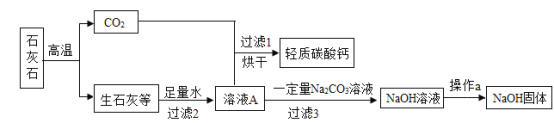
(1)操作a的名称是_____。
(2)该流程中有两个反应,产物中均出现碳酸钙,这两个反应的化学方程式分别为:_____、_____。
(3)为了验证加入Na2CO3溶液后,溶液A中的溶质是否反应完全,可取过滤3的滤液加入_____(填字母)进行检验。
A碳酸钠溶液 B铁粉 C无色酚酞 D足量盐酸
(4)工业上高温煅烧石灰石生产生石灰,若要生产含氧化钙5.6t的生石灰,需要含碳酸钙80%的石灰石的质量是多少?_____(根据化学方程式计算,写出计算过程)
【答案】蒸发 ![]()
![]() A 12.5t
A 12.5t
【解析】
(1)氢氧化钠溶液经过操作a变为氢氧化钠固体,故操作a的名称是:蒸发;
(2)石灰石的主要成分是碳酸钙,碳酸钙在高温的条件下分解为氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:![]() ;氢氧化钙也能与碳酸钠反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:
;氢氧化钙也能与碳酸钠反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:![]() ;
;
(3)氧化钙与水反应生成氢氧化钙,故溶液A中的溶质为氢氧化钙,加入碳酸钠,![]() ,过滤,除去碳酸钙,如果氢氧化钙未完全反应,则滤液中含有氢氧化钙、氢氧化钠,如果氢氧化钙和碳酸钠恰好完全反应,则滤液中含有氢氧化钠,如碳酸钠过量,则滤液中含有氢氧化钠、碳酸钠。
,过滤,除去碳酸钙,如果氢氧化钙未完全反应,则滤液中含有氢氧化钙、氢氧化钠,如果氢氧化钙和碳酸钠恰好完全反应,则滤液中含有氢氧化钠,如碳酸钠过量,则滤液中含有氢氧化钠、碳酸钠。
A、向滤液中加入碳酸钠溶液,如果氢氧化钙未完全反应,氢氧化钙能与碳酸钠反应生成碳酸钙和氢氧化钠,有白色沉淀产生,如果氢氧化钙已经完全反应,则无白色沉淀产生,符合题意;
B、向滤液中加入铁粉,铁与氢氧化钙、氢氧化钠、碳酸钠都不能反应,无法验证溶液A中的溶质是否反应完全,不符合题意;
C、向滤液中加入无色酚酞,碳酸钠、氢氧化钠、氢氧化钙都显碱性,都能使无色酚酞试液变红,无法验证溶液A中的溶质是否反应完全,不符合题意;
D、向滤液中加入足量盐酸,盐酸能与氢氧化钙反应生成氯化钙和水,无明显现象,盐酸与氢氧化钠反应生成氯化钠和水,无明显现象,盐酸能与碳酸钠反应生成氯化钠、二氧化碳和水,有气泡产生,故如无明显现象,可能是氢氧化钙未完全反应,也可能是氢氧化钙和碳酸钠恰好完全反应,如果产生气泡,则说明碳酸钠过量,氢氧化钙已经完全反应,故足量盐酸只能验证碳酸钠是否过量,氢氧化钙恰好完全反应时,无法验证,不符合题意。
故选A;
(4)解:设需要含碳酸钙80%的石灰石的质量是x
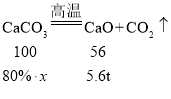
![]()
x=12.5t
答:需要含碳酸钙80%的石灰石的质量是12.5t。

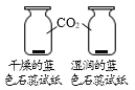
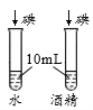
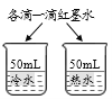
【题目】控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )
|
|
|
|
A.探究铁、镁金属活动性强弱 | B.探究二氧化碳与水是否发生反应 | C.探究不同溶剂中物质溶解性大小 | D.探究温度对分子运动快慢的影响 |
A. AB. BC. CD. D
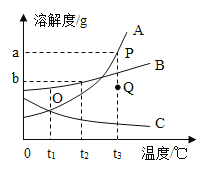
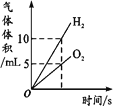
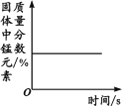
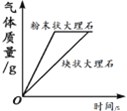
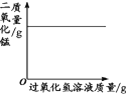
【题目】下列图像不能正确反映对应变化关系的是
|
|
|
|
A.将水通电电解一 段时间 | B.加热一定量的高 锰酸钾固体 | C.向两份相等质量的块状大理石和粉末状大理石中分别加入过量的等浓度的稀盐酸 | D.向一定量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D
【题目】在探究铝化学性质时发现铝与稀盐酸反应比与稀硫酸反应剧烈,化学兴趣小组进行了如下探究:
(1)铝与稀盐酸反应的化学方程式为_____。
(2)铝片使用前需要打磨的原因是_____,铝能被用来制作导线是因为其具有_____性。
(3)实验过程中,可以通过观察_____来比较铝与稀盐酸和稀硫酸反应的剧烈程度。
(4)(作出猜想)猜想一:Cl-对反应起了促进作用;
猜想二:SO![]() 对反应起了阻碍作用;
对反应起了阻碍作用;
猜想三:以上两种猜想同时成立。
(进行实验)
实验 | 实验操作 |
实验1 | 将铝片加入到10mLpH=1的稀盐酸中,然后向其中滴加CuSO4溶液 |
实验2 | 将铝片加入到10mLpH=1的稀硫酸中,然后向其中滴加浓盐酸 |
实验3 | 将铝片加入到10mLpH=1的稀盐酸中,然后向其中滴加Na2SO4溶液 |
(分析并得出结论)
①同学们认为实验1不可行,理由是_____。
②同学们认为实验2思路不正确,改进的方法是_____。
③实验3没有明显现象,证明猜想_____不成立。