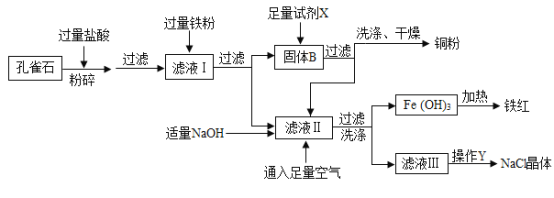
题目内容
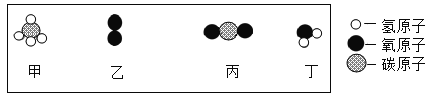
【题目】如图是汽车尾气在一种“铂催化剂”的催化下净化的微观反应过程。下列说法正确的是( )
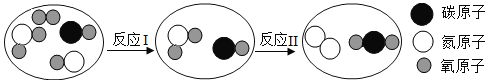
A.该微观反应过程中出现三种化合物
B.反应Ⅰ前后分子改变、原子减少
C.“铂催化剂”在反应结束后质量改变
D.反应Ⅱ中氮元素的化合价改变
【答案】D
【解析】
由图示可知,反应Ⅰ是NO与O2反应生成NO2,由反应的微观过程图可知,反应Ⅱ是二氧化氮与一氧化碳在催化剂的作用下反应生成了二氧化碳和氮气,反应的方程式是:2NO2+4CO N2+4CO2。
N2+4CO2。
A、由图示和方程式可知,该微观反应过程中出现CO、NO、CO2、NO2四种化合物,故选项错误;
B、由图示可知,反应前后分子改变,原子不变,故选项错误;
C、催化剂在反应前后质量不变,故选项错误;
D、反应Ⅱ为2NO2+4CO N2+4CO2,反应物二氧化氮中氧的化合价为-2价,设氮元素的化合价为x,则有x+(-2)×2=0,解得x=+4,故氮元素的化合价为+4价,反应后生成氮气单质,氮元素的化合价为0,故氮元素的化合价由+4变为0价,故选项正确。故选D。
N2+4CO2,反应物二氧化氮中氧的化合价为-2价,设氮元素的化合价为x,则有x+(-2)×2=0,解得x=+4,故氮元素的化合价为+4价,反应后生成氮气单质,氮元素的化合价为0,故氮元素的化合价由+4变为0价,故选项正确。故选D。

【题目】在探究铝化学性质时发现铝与稀盐酸反应比与稀硫酸反应剧烈,化学兴趣小组进行了如下探究:
(1)铝与稀盐酸反应的化学方程式为_____。
(2)铝片使用前需要打磨的原因是_____,铝能被用来制作导线是因为其具有_____性。
(3)实验过程中,可以通过观察_____来比较铝与稀盐酸和稀硫酸反应的剧烈程度。
(4)(作出猜想)猜想一:Cl-对反应起了促进作用;
猜想二:SO![]() 对反应起了阻碍作用;
对反应起了阻碍作用;
猜想三:以上两种猜想同时成立。
(进行实验)
实验 | 实验操作 |
实验1 | 将铝片加入到10mLpH=1的稀盐酸中,然后向其中滴加CuSO4溶液 |
实验2 | 将铝片加入到10mLpH=1的稀硫酸中,然后向其中滴加浓盐酸 |
实验3 | 将铝片加入到10mLpH=1的稀盐酸中,然后向其中滴加Na2SO4溶液 |
(分析并得出结论)
①同学们认为实验1不可行,理由是_____。
②同学们认为实验2思路不正确,改进的方法是_____。
③实验3没有明显现象,证明猜想_____不成立。
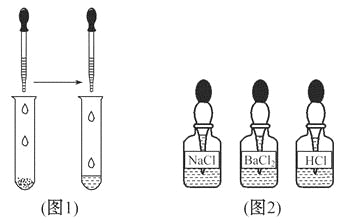
【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
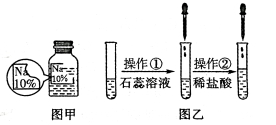
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。