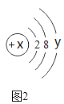题目内容
【题目】学习了碳单质的化学性质,知道碳与氧气反应能够生成CO2或CO后,某学习小组同学联想到木炭粉与氧化铜发生反应可能有:①2CuO+C![]() 2Cu+CO2↑;②CuO+C
2Cu+CO2↑;②CuO+C![]() Cu+CO↑。他们想验证自已的想法,请你同他们一起进行探究。
Cu+CO↑。他们想验证自已的想法,请你同他们一起进行探究。
(猜想与假设)
木炭粉与氧化铜反应生成的产物有三种可能:
(1)产物是铜和一氧化碳;
(2)产物是铜和二氧化碳;
(3)产物是____________________。
(设计方案)
(1)检验产物中是否有CO2的方法是_____________________(用化学方程式表示)。
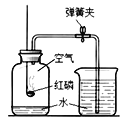
(2)如何检验产物是否存在CO,学习小组同学找查了资料: CO的特征反应是CO能使某种氯化钯的黄色混合液变蓝。
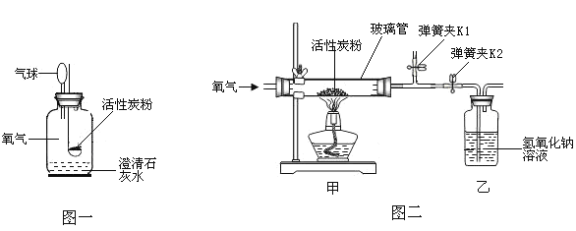
(实验结论)设计的实验装置(如图)
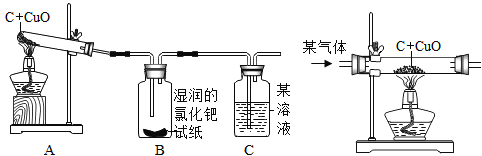
实验报告:
实验现象 | 实验结论 |
①A中________________ | ①有铜生成 |
②B中黄色试纸变蓝 | ②有______________生成 |
③C中_______________ | ③有CO2生成 |
(反思与评价)
(1)实验结束时,为防止Cu被氧化,必须先停止加热,待Cu冷却后再将试管口的胶塞取下,因此,若没有B瓶,可能导致的后果是__________________。
(2)从环保角度看,如图装置有缺陷,怎么办?___________________。
(3)检验生成的气体中是否含有CO,也可以将混合气体通过灼热的氧化铜粉末,看黑色固体是否会逐渐变红,写出相关反应的化学方程式_____________________。
(拓展与延伸)
(1)若采用如图装置代替图中A装置,既可排尽试管中的空气,还可以将反应产生的气体赶出来,那么通入的“某气体”是什么?________________________。
(2)假若24.4g木炭粉与氧化铜混合物充分反应后,只生成二氧化碳气体,且反应后剩余固体质量为20g。求剩余固体中金属铜的质量分数__________________。
【答案】铜、一氧化碳和二氧化碳 ![]() 黑色固体变红 一氧化碳 澄清石灰水变浑浊 C中的石灰石倒流进入试管使试管炸裂 应在C后增加尾气处理装置
黑色固体变红 一氧化碳 澄清石灰水变浑浊 C中的石灰石倒流进入试管使试管炸裂 应在C后增加尾气处理装置 ![]() 氮气 64%
氮气 64%
【解析】
猜想与假设:
木炭粉与氧化铜反应会生成铜和一氧化碳、或生成铜和二氧化碳,故木炭粉与氧化铜反应生成的产物的第三种可能为:
(3)产物是铜、一氧化碳和二氧化碳。
设计方案:
(1)检验产物中是否有二氧化碳的方法是将生成的气体通入澄清石灰水中,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:![]() 。
。
实验结论:
实验报告:
在高温条件下,碳和黑色的氧化铜反应生成红色的铜和二氧化碳,一氧化碳能使某种氯化钯的黄色混合液变蓝,二氧化碳能使澄清石灰水变浑浊,故有:
实验现象 | 实验结论 |
①A中黑色固体变红 | ①有铜生成 |
②B中黄色试纸变蓝 | ②有一氧化碳生成 |
③C中澄清石灰水变浑浊 | ③有CO2生成 |
反思与评价:
(1)实验结束时,为防止Cu被氧化,必须先停止加热,待Cu冷却后再将试管口的胶塞取下,因此,若没有B瓶,可能导致的后果是C中的石灰石倒流进入试管使试管炸裂。
(2)从环保角度看,如图装置有缺陷,应在C后增加尾气处理装置。
(3)检验生成的气体中是否含有CO,也可以将混合气体通过灼热的氧化铜粉末,看黑色固体是否会逐渐变红,一氧化碳与灼热的氧化铜反应生成铜和二氧化碳,反应的化学方程式为:![]() 。
。
拓展与延伸:
(1)若采用如图装置代替图中A装置,既可排尽试管中的空气,还可以将反应产生的气体赶出来,那么通入的“某气体”是氮气,因为氮气的化学性质很不活泼,不与装置中各药品发生反应。
(2)假若24.4g木炭粉与氧化铜混合物充分反应后,只生成二氧化碳气体,且反应后剩余固体质量为20g,根据质量守恒定律,生成二氧化碳的质量为24.4g-20g=4.4g,设生成铜的质量为x,则
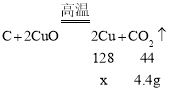
![]()
解得x=12.8g;
剩余固体中金属铜的质量分数为![]() 。
。