题目内容
【题目】完成下列反应的化学方程式,并按要求填空
(1)湿法(硫酸铜溶液)炼铜原理:_________________;实验过程溶液颜色由蓝色逐渐变成________色。
(2)铁与稀盐酸反应:____________________;其基本反应类型是___________。
(3)常温下,铝与空气中的氧气反应___________________,铝在空气中具有较好的抗腐蚀性能的原因是___________________。
(4)二氧化碳与碳在高温条件下反应:_______________________,该反应为__________热反应。
【答案】![]() 浅绿
浅绿 ![]() 置换反应
置换反应 ![]() 铝在空气中易形成致密的氧化铝膜,从而阻止铝进一步被氧化
铝在空气中易形成致密的氧化铝膜,从而阻止铝进一步被氧化 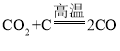 吸
吸
【解析】
(1)湿法(硫酸铜溶液)炼铜原理是用硫酸将铜矿中的铜转变成可溶性的硫酸铜,再将铁放入硫酸铜溶液中把铜置换出来,反应的化学方程式为![]() ;实验过程溶液颜色由蓝色逐渐变成浅绿色。
;实验过程溶液颜色由蓝色逐渐变成浅绿色。
(2)铁与稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为![]() ;反应符合一种单质和一种化合物反应生成另一种单质和另一种化合物,故其基本反应类型是置换反应。
;反应符合一种单质和一种化合物反应生成另一种单质和另一种化合物,故其基本反应类型是置换反应。
(3)常温下,铝与空气中的氧气反应生成氧化铝,反应的化学方程式为
![]() ,铝在空气中具有较好的抗腐蚀性能的原因是铝在空气中易形成致密的氧化铝膜,从而阻止铝进一步被氧化。
,铝在空气中具有较好的抗腐蚀性能的原因是铝在空气中易形成致密的氧化铝膜,从而阻止铝进一步被氧化。
(4)二氧化碳与碳在高温条件下反应生成一氧化碳,反应的化学方程式为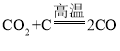 ,该反应为吸热反应。
,该反应为吸热反应。

【题目】学习了碳单质的化学性质,知道碳与氧气反应能够生成CO2或CO后,某学习小组同学联想到木炭粉与氧化铜发生反应可能有:①2CuO+C![]() 2Cu+CO2↑;②CuO+C
2Cu+CO2↑;②CuO+C![]() Cu+CO↑。他们想验证自已的想法,请你同他们一起进行探究。
Cu+CO↑。他们想验证自已的想法,请你同他们一起进行探究。
(猜想与假设)
木炭粉与氧化铜反应生成的产物有三种可能:
(1)产物是铜和一氧化碳;
(2)产物是铜和二氧化碳;
(3)产物是____________________。
(设计方案)
(1)检验产物中是否有CO2的方法是_____________________(用化学方程式表示)。
(2)如何检验产物是否存在CO,学习小组同学找查了资料: CO的特征反应是CO能使某种氯化钯的黄色混合液变蓝。
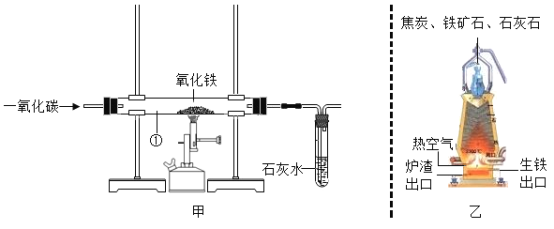
(实验结论)设计的实验装置(如图)
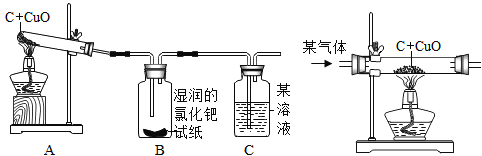
实验报告:
实验现象 | 实验结论 |
①A中________________ | ①有铜生成 |
②B中黄色试纸变蓝 | ②有______________生成 |
③C中_______________ | ③有CO2生成 |
(反思与评价)
(1)实验结束时,为防止Cu被氧化,必须先停止加热,待Cu冷却后再将试管口的胶塞取下,因此,若没有B瓶,可能导致的后果是__________________。
(2)从环保角度看,如图装置有缺陷,怎么办?___________________。
(3)检验生成的气体中是否含有CO,也可以将混合气体通过灼热的氧化铜粉末,看黑色固体是否会逐渐变红,写出相关反应的化学方程式_____________________。
(拓展与延伸)
(1)若采用如图装置代替图中A装置,既可排尽试管中的空气,还可以将反应产生的气体赶出来,那么通入的“某气体”是什么?________________________。
(2)假若24.4g木炭粉与氧化铜混合物充分反应后,只生成二氧化碳气体,且反应后剩余固体质量为20g。求剩余固体中金属铜的质量分数__________________。
【题目】在一次市级化学研讨课上,师生一起探究人们吸入的空气和呼出的气体有什么不同。空气的成分按体积计算,大约是:氮气占78%、O2占______、稀有气体占0.94%、CO2占0.03%、其它气体和杂质占0.03%。
(提出问题)呼出的气体中主要含有哪些物质?它们的含量是多少?
(实验探究)
(1)某小组设计了下列实验方案,请你帮助该小组同学完成下列表格。
实验 | 实验操作 | 实验现象 | 结论 |
1 | 取两块干燥的玻璃片,向一块干燥玻璃片上哈气 | 哈气的玻璃片上____________ | 呼出的气体中含有较多水蒸气 |
2 | 向澄清的石灰水中吹气 | 澄清石灰水变浑浊 | 呼出的气体中含有较多的CO2 |
(2)写出实验2反应的化学方程式____________。
(3)该小组同学在进行交流时其他同学对他们的设计提出质疑,认为实验2没有进行对照实验,得出的结论不可靠,提出质疑的理由是_________。针对同学的质疑,化学老师用CO2传感器测量呼出的气体中CO2的含量(体积分数)曲线如图。
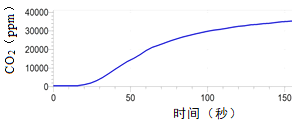
(得出结论)人呼出的气体水蒸气、二氧化碳的含量比空气中________。
(4)请设计实验探究人体吸入的空气和呼出的气体中氧气的含量的差异。
实验操作 | 实验现象 | 结论 |
_________ | _________ | _________ |