��Ŀ����
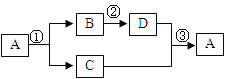
����Ŀ��ͬѧ�Ƕ�H2O2��Һ�ֽ�ķ�Ӧ���ʵ�Ӱ�����ؽ���̽����
ʵ��1��̽��H2O2��ҺŨ�ȡ��¶ȶԷ�Ӧ���ʵ�Ӱ��
��ʵ�鷽������һ���¶��£�����ͬ������H2O2��Һ�м�����ͬ������MnO2��ĩ�������ռ�150 mL O2�����ʱ�䡣
ʵ����� | H2O2��Һ��Ũ��/% | �¶�/�� | ʱ��/s |
I | 30 | 20 | ���� |
II | 15 | 30 | ���� |
III | a | b | ���� |
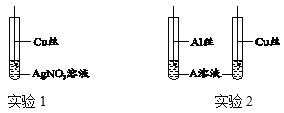
ʵ��2��������ͼװ�ý���ʵ��(����������ȥ)��̽����������Է�Ӧ���ʵ�Ӱ��
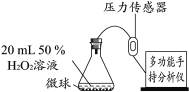
����ͬ������MnO2��CuO��Fe2O3��Cr2O3���ִ�����(������ȡ��������ͬ)���ֱ����ʵ�飬��ƿ��ѹǿ��ʱ��ı仯����ͼ��

����������ۣ�
(1)ʵ��1�з�Ӧ�Ļ�ѧ����ʽ��______����Ҫ�Ƶ�3.2 gO2����ҪH2O2������Ϊ______g��
(2)Ϊ�˴ﵽʵ��1��Ŀ�ģ���ȫʵ�鷽����
�� ��a��b����ȣ���a=______��b=______��
�� ��a��b��ȣ������ʵ��I��III��Ŀ����______��
(3)ʵ��2��ʹ����ͬ�����������ԭ����______��
(4)ͨ����ʵ��2���ݵķ������ɵó��Ľ�����______��
����˼�����ۣ�
(5)ʵ��1��ͨ�������ռ������O2����ʱ�����Ƚ�H2O2��Һ�ķ�Ӧ���ʣ�������ͨ������______���Ƚ�H2O2��Һ�ķ�Ӧ���ʡ�
���𰸡�2H2O2![]() 2H2O+O2
2H2O+O2![]() 6.8 15 20 ̽���¶ȶ�H2O2�ֽⷴӦ���ʵ�Ӱ�� ʹÿ��ʵ���д�����H2O2��Һ�ĽӴ����������������� ����������ͬʱ������������Ի�ѧ��Ӧ������Ӱ�� ��ͬʱ���ռ���O2�����
6.8 15 20 ̽���¶ȶ�H2O2�ֽⷴӦ���ʵ�Ӱ�� ʹÿ��ʵ���д�����H2O2��Һ�ĽӴ����������������� ����������ͬʱ������������Ի�ѧ��Ӧ������Ӱ�� ��ͬʱ���ռ���O2�����
��������
(1) ʵ��1�з�Ӧ��H2O2��ҺMnO2������������ѧ����ʽΪ2H2O2![]() 2H2O+O2
2H2O+O2![]() ��
��
�⣺����Ҫ�Ƶ�3.2 gO2����ҪH2O2������Ϊx

![]()
x=6.8g
����Ҫ�Ƶ�3.2 gO2����ҪH2O2������Ϊ6.8g
(2)ʵ��1��Ŀ��̽��H2O2��ҺŨ�ȡ��¶ȶԷ�Ӧ���ʵ�Ӱ��, ��a��b����ȣ��������ÿ��Ʊ�����������Ũ����I��II֮����СŨ����ȣ���a=15��
�����¶���I��II֮������¶���ȣ���b=20��
��a��b��ȣ����ÿ��Ʊ������ɵã�a=b=30����I��III��H2O2��ҺŨ����ȣ��¶Ȳ��ȣ����ʵ��Ŀ����̽���¶ȶ�H2O2�ֽⷴӦ���ʵ�Ӱ�죻
(3)ʵ��2��ʹ����ͬ�����������ԭ����ʹÿ��ʵ���д�����H2O2��Һ�ĽӴ����������������ȣ�
(4) ʵ��2����ȵ���H2O2��ҺŨ�ȡ��¶ȣ���ͬ���Ǵ������࣬��ͨ����ʵ��2���ݵķ������ɵó��Ľ���������������ͬʱ������������Ի�ѧ��Ӧ������Ӱ�죻
(5) ʵ��1��ͨ�������ռ������O2����ʱ�����Ƚ�H2O2��Һ�ķ�Ӧ���ʣ�������ͨ��������ͬʱ���ռ���O2��������Ƚ�H2O2��Һ�ķ�Ӧ����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ʵ��̽����
����Ƶ����������𣿡���Ŀ����һ����Ƶ��������ֽ������һ����ͷ���м�խ��ֽ����Ȼ����ͷ�ֱ����ӵ�ص����������۲쵽����ֽ������ȼ�ա��ݴˣ�ijͬѧȡ����ֽ������������̽����
̽��һ������ֽ��ȼ�յ�ԭ��
����ֽ�����˽�������������ɶ�·��ʹ����ֽ��ȼ�գ���ȼ�յ�������ʼ����ֽ����ȼ�յ���·��ȴ��ȼ�յ�ԭ����______��
̽����������ֽ���н����ijɷ�
��������⣩����ֽ���еĽ���������
���������ϣ�������ֽ��������������
��п����һ�����ɫ����
������Sn������������������Һ��Ӧ����+2�����Ļ�����
��������룩����I������ֽ���еĽ����������������ֽ���еĽ�������
������ʵ�飩��Ʒ���������ʵ��
ʵ����� | ʵ������ | ʵ���������� |
ȡ��ĥ�������ֽ��Ƭ���� �Թ��У��μ��Ȼ�п��Һ | ����ֽ�������� ���ɫ�������� | ����ʵ������Ͻ������˳�� ��֪���� ______ ��������Ӧ�Ļ�ѧ����ʽΪ ______ �� |
���������ۣ���1��ʵ���д�ĥ����ֽ����Ŀ����______��
��2���������ʵ���Һ��������Ȼ�п��Һ�������ʵ�����______������ĸ��ţ�
A���Ȼ�ͭ B�������� C�������� D����������
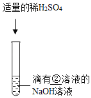
����չӦ�ã�֤������ͭ�������ֽ������˳���ʵ�鷽�����£��뽫���ݲ�������
ʵ����� | ʵ������ | ʵ����� |
| ��A/BΪ��������CΪ ______ �������ƣ���Һ��������Ӧ���Թ��й۲쵽������Ϊ ______ �� ��Ӧ�Ļ�ѧ����ʽΪ ______ �� | ����ͭ�������ֽ����Ļ��˳���ǣ� Fe��Cu��Ag |
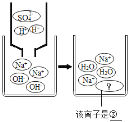
����Ŀ����һ����ij��������μ���ij��Һ��������x���ʾ������Һ������������ѡ����y���ʾ�ĺ���������ͼ��仯����һ�µ��ǣ� ��
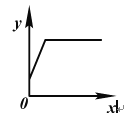
ѡ�� | ���� | ��Һ | y�Ậ�� |
A | �������� | ����������Һ | ˮ������ |
B | ���ۺ�ͭ�� | ����ͭ��Һ | ������Һ������ͭ������ |
C | ����ʯ(���ʲ��μӷ�Ӧ) | ϡ���� | ���������ʵ��������� |
D | �Ȼ��ƺ�̼�����ƻ���� | ϡ���� | ������̼����� |
A. A B. B C. C D. D
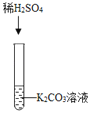
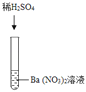
����Ŀ��ij��ѧ��ȤС���ͬѧ����ʵ������̽��ijЩ�ᡢ���֮���Ƿ������ֽⷴӦ��
���������ϣ����ᱵ��BaSO4����ɫ���壬������ˮ��Ҳ���������ᡢ��������ᡣ
��ʵ����̽����
���� | ���� | ʵ����� | ���� | |
ʵ��һ |
| ��_____ | ��ѧ����ʽ�ǣ�K2CO3+H2SO4�TK2SO4+H2O+CO2�� | ����������������Т�___���г�������ʱ�����ֽⷴӦ���Է����� |
ʵ��� |
��_____ | ��Һ��ɫ�ɺ�ɫǡ�ñ�Ϊ��ɫ |
��_____ | |
ʵ���� |
| ������ɫ���� | �÷�Ӧ��ʵ���ǣ�Ba2++SO42���TBaSO4�� |
ʵ����������ijͬѧ���ں��棬��ʵ�����Թ�����ϲ���Һa������һ֧�ྻ���Թ��У�����Һa����εμ�K2CO3��Һ���ڵμӹ����У������Ȳ������ݣ�Ȼ���ֲ�����ɫ�����������������������ж�ԭ��Һa�е�������_____��
����չ��Ӧ�ã���ϡ����Ca��OH��2��ҺNaCl��ҺNa2CO3��Һ����������Һ���ϣ��ܷ�����Ӧ�Ĺ���_____�顣