题目内容
【题目】人们都需要洁净的空气。但是受人类生产、生活等因素的影响,全球性空气污染程度越来越严重,最近,一场面积超过百万平方公里的雾霾天气席卷我国北方。
(1)大雾天气导致呼吸病人增多,因为雾霾可使空气中增加大量的_____(填字母序号);
A.二氧化碳 B.一氧化碳 C.二氧化硫 D.可吸入颗粒物
(2)常见的化石燃料有_____、石油和天然气。乙醇属于可再生能源,乙醇在氧气中燃烧的化学方程式为:_____。
(3)下列关于“节约能源、保护环境”的做法正确的是_____。
A.直接排放工业废水 B.使用塑料袋
C.发展太阳能、风能等新能源 D.大力发展火力发电
【答案】D 煤; C2H5OH+3O2![]() 2CO2+3H2O C
2CO2+3H2O C
【解析】
(1)大雾天气可导致呼吸病人增多,因为雾霾中有一些直径小于或等于2.5微米的颗粒物,可使空气中增加大量的可吸入颗粒物,故选D;
(2)常见的化石燃料有煤、石油和天然气煤;乙醇与氧气在点燃的条件下反应生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2![]() 2CO2+3H2O;
2CO2+3H2O;
(3)A、工业废水是造成水体污染的重要原因之一,直接排放工业废水,会污染环境,故A错误;
B、使用塑料袋,会造成白色污染,不利于环境的保护,故B错误;
C、开发太阳能、水能、风能、地热等新能源,这些都是清洁可循环利用的能源,有利于环境的保护,故C正确;
D、火力发电是用煤做燃料,所以会产生大量的空气污染物,不利于环保,故D错误。故选C。

 阅读快车系列答案
阅读快车系列答案【题目】同学们对H2O2溶液分解的反应速率的影响因素进行探究。
实验1:探究H2O2溶液浓度、温度对反应速率的影响
(实验方案)在一定温度下,向相同质量的H2O2溶液中加入相同质量的MnO2粉末,测量收集150 mL O2所需的时间。
实验序号 | H2O2溶液的浓度/% | 温度/℃ | 时间/s |
I | 30 | 20 | 待测 |
II | 15 | 30 | 待测 |
III | a | b | 待测 |
实验2:依据下图装置进行实验(部分仪器略去),探究催化剂种类对反应速率的影响
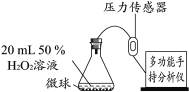
用相同粒数的MnO2、CuO、Fe2O3、Cr2O3四种催化剂微球(质量相等、表面积相同),分别进行实验,锥形瓶内压强随时间的变化如下图。

(解释与结论)
(1)实验1中反应的化学方程式是______。若要制得3.2 gO2,需要H2O2的质量为______g。
(2)为了达到实验1的目的,补全实验方案。
① 若a与b不相等,则a=______;b=______。
② 若a与b相等,则设计实验I、III的目的是______。
(3)实验2中使用相同粒数催化剂微球的原因是______。
(4)通过对实验2数据的分析,可得出的结论是______。
(反思与评价)
(5)实验1是通过测量收集等体积O2所需时间来比较H2O2溶液的反应速率,还可以通过测量______来比较H2O2溶液的反应速率。