题目内容
【题目】实验探究:
央视频道《是真的吗?》栏目中有一段视频:将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧。据此,某同学取“锡纸”进行了以下探究:
探究一:“锡纸”燃烧的原因
“锡纸”两端接入电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件开始“锡纸”不燃烧但短路后却能燃烧的原因是______。
探究二:“锡纸”中金属的成分
(提出问题)“锡纸”中的金属是锡吗?
(査阅资料)①“锡纸”是锡箔或铝箔
②锌粉是一种深灰色固体
③锡(Sn)与酸或金属化合物溶液反应生成+2价锡的化合物
(提出猜想)猜想I:“锡纸”中的金属是锡猜想Ⅱ:“锡纸”中的金属是铝
(进行实验)设计方案并进行实验
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入 试管中,滴加氯化锌溶液 | “锡纸”表面有 深灰色固体析出 | 根据实验现象,结合金属活动性顺序 可知猜想 ______ 成立;反应的化学方程式为 ______ 。 |
(交流讨论)(1)实验中打磨“锡纸”的目的是______。
(2)下列物质的溶液可以替代氯化锌溶液完成上述实验的是______(填字母序号)
A.氯化铜 B.硝酸银 C.硫酸钠 D.硫酸亚铁
(拓展应用)证明铁、铜、银三种金属活动性顺序的实验方案如下,请将内容补充完整
实验操作 | 实验现象 | 实验结论 |
| 若A/B为金属,则C为 ______ (填名称)溶液,则发生反应的试管中观察到的现象为 ______ , 反应的化学方程式为 ______ 。 | 铁、铜、银三种金属的活动性顺序是: Fe>Cu>Ag |
【答案】温度达到着火点 Ⅱ 2Al+3ZnCl2=3Zn+2AlCl3 除去表面的氧化物 D CuSO4 铁片表面有红色固体析出,溶液由蓝色变为浅绿色 CuSO4+Fe=FeSO4+Cu
【解析】
可燃物燃烧的条件:与氧气接触,温度达到可燃物着火点;铝、锡都比铜、银活泼,因此都能够和氯化铜、硝酸银反应;铝、锡都不如钠活泼,因此都不能和硫酸钠反应;铝比铁活泼,能和硫酸亚铁反应,锡不如铁活泼,不能和硫酸亚铁反应。
探究一:“锡纸”始终和氧气接触,两端接入电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件开始“锡纸”不燃烧但短路后却能燃烧的原因是温度达到着火点;
探究二:【进行实验】取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液,“锡纸”表面有深灰色固体析出,析出了锌,说明“锡纸”是铝箔,这是因为铝比锌活泼,能和氯化锌反应生成氯化铝和锌,反应的化学方程式为:2Al+3ZnCl2═2AlCl3+3Zn,而锡不如锌活泼,不能和氯化锌反应,实验过程如下所示:
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序可知猜想II成立;反应的化学方程式为:2Al+3ZnCl2═2AlCl3+3Zn. |
【交流讨论】
(1)实验中打磨“锡纸”的目的是除去表面的氧化物。故填:除去表面的氧化物;
(2)铝、锡都比铜、银活泼,因此都能够和氯化铜、硝酸银反应,不能用来完成实验;
铝、锡都不如钠活泼,因此都不能和硫酸钠反应,不能用来完成实验;
铝比铁活泼,能和硫酸亚铁反应,锡不如铁活泼,不能和硫酸亚铁反应,因此可以用来完成实验。故选D;
【拓展应用】
在 金属活动性顺序中,Fe>Cu>Ag,使用活动性强的金属铁和活动性弱的金属银,则可以用铜的盐溶液。所以,实验方案是:把铁和银放入硫酸铜溶液中,铁表面有红色物质析出,溶液由蓝色变为浅绿色,银与硫酸铜不反应,证明锌铁的活动性比铜强,铜的活动性比银强;发生反应的化学方程式为:CuSO4+Fe=FeSO4+Cu。

【题目】同学们对H2O2溶液分解的反应速率的影响因素进行探究。
实验1:探究H2O2溶液浓度、温度对反应速率的影响
(实验方案)在一定温度下,向相同质量的H2O2溶液中加入相同质量的MnO2粉末,测量收集150 mL O2所需的时间。
实验序号 | H2O2溶液的浓度/% | 温度/℃ | 时间/s |
I | 30 | 20 | 待测 |
II | 15 | 30 | 待测 |
III | a | b | 待测 |
实验2:依据下图装置进行实验(部分仪器略去),探究催化剂种类对反应速率的影响
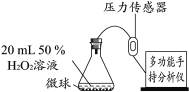
用相同粒数的MnO2、CuO、Fe2O3、Cr2O3四种催化剂微球(质量相等、表面积相同),分别进行实验,锥形瓶内压强随时间的变化如下图。

(解释与结论)
(1)实验1中反应的化学方程式是______。若要制得3.2 gO2,需要H2O2的质量为______g。
(2)为了达到实验1的目的,补全实验方案。
① 若a与b不相等,则a=______;b=______。
② 若a与b相等,则设计实验I、III的目的是______。
(3)实验2中使用相同粒数催化剂微球的原因是______。
(4)通过对实验2数据的分析,可得出的结论是______。
(反思与评价)
(5)实验1是通过测量收集等体积O2所需时间来比较H2O2溶液的反应速率,还可以通过测量______来比较H2O2溶液的反应速率。