题目内容
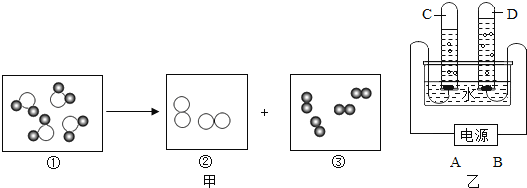
【题目】某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。
(査阅资料)硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
(实验与探究)
内容 | 现象 | 实验解析 | 结论 | |
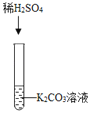
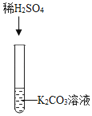
实验一 |
| ①_____ | 化学方程式是:K2CO3+H2SO4═K2SO4+H2O+CO2↑ | 生成物中有气体或有④___或有沉淀生成时,复分解反应可以发生。 |
实验二 |
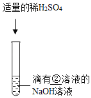
②_____ | 溶液颜色由红色恰好变为无色 |
③_____ | |
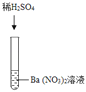
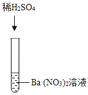
实验三 |
| 产生白色沉淀 | 该反应的实质是:Ba2++SO42﹣═BaSO4↓ |
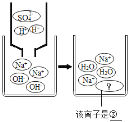
实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是_____。
(拓展与应用)将稀盐酸Ca(OH)2溶液NaCl溶液Na2CO3溶液任意两种溶液相混合,能发生反应的共有_____组。
【答案】有气泡产生; 酚酞试液; SO42﹣(或硫酸根离子或硫酸根均可); 水(或H2O); HNO3和Ba(NO3)2(或硝酸和硝酸钡); 3。
【解析】
【实验与探究】碳酸盐和酸反应会生成二氧化碳,酚酞遇碱变红色,酸、碱发生中和反应生成盐和水,复分解反应发生的条件是:生成物中有气体或有④水或有沉淀生成,所以
内容 | 现象 | 实验解析 | 结论 | |
实验一 |
| ①有气泡产生 | 化学方程式是:K2CO3+H2SO4═K2SO4+H2O+CO2↑ | 生成物中有气体或有④水或有沉淀生成时,复分解反应可以发生。 |
实验二 |
②酚酞试液 | 溶液颜色由红色恰好变为无色 |
③SO42﹣ | |
实验三 |
| 产生白色沉淀 | 该反应的实质是:Ba2++SO42﹣═BaSO4↓ |
氢离子和碳酸根离子反应会生成二氧化碳,钡离子和碳酸根离子反应会生成碳酸钡沉淀,所以把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是⑤HNO3和Ba(NO3)2;
【拓展与应用】将稀盐酸、Ca(OH)2溶液、NaCl溶液、Na2CO3溶液两两混合时,稀盐酸能与氢氧化钙反应生成氯化钙和水;稀盐酸能与碳酸钠反应生成氯化钠、水和二氧化碳;氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,共能发生3个反应。

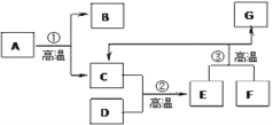
【题目】铁与水蒸气在高温条件下反应生成了一种铁的氧化物和一种气体单质,实验装罝如下图所示。
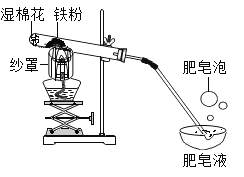
(1)试管尾部放一团湿棉花的目的是__________。
(2)用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到上方空气中。说明生成的气体是__________。
(3)探宄试管中剩余固体的成分。
(査阅资料)
①几种常见铁的氧化物的颜色、状态及能否被磁铁吸引如下表所示。
常见铁的氧化物 | FeO | Fe2O3 | Fe304 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色品体 |
能否被磁铁吸引 | 否 | 否 | 能 |
②四氧化三铁能与稀硫酸反应:
Fe304+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步实验验证)
试管中剩余间体为黑色,能全部被磁铁吸引,则剩余固体一定不含氧化物__________、__________。
(猜想与假设)
猜想一:剩余固体是Fe304;
猜想二:剩余固体是__________。
(继续进行实验)
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,滴加足量的稀硫酸。 | _____________。 | 猜想一不成立, 猜想二成立。 |
(实验结论)铁和水蒸气反应的化学方程式为____________________。
【题目】同学们对H2O2溶液分解的反应速率的影响因素进行探究。
实验1:探究H2O2溶液浓度、温度对反应速率的影响
(实验方案)在一定温度下,向相同质量的H2O2溶液中加入相同质量的MnO2粉末,测量收集150 mL O2所需的时间。
实验序号 | H2O2溶液的浓度/% | 温度/℃ | 时间/s |
I | 30 | 20 | 待测 |
II | 15 | 30 | 待测 |
III | a | b | 待测 |
实验2:依据下图装置进行实验(部分仪器略去),探究催化剂种类对反应速率的影响
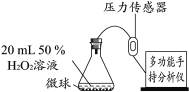
用相同粒数的MnO2、CuO、Fe2O3、Cr2O3四种催化剂微球(质量相等、表面积相同),分别进行实验,锥形瓶内压强随时间的变化如下图。

(解释与结论)
(1)实验1中反应的化学方程式是______。若要制得3.2 gO2,需要H2O2的质量为______g。
(2)为了达到实验1的目的,补全实验方案。
① 若a与b不相等,则a=______;b=______。
② 若a与b相等,则设计实验I、III的目的是______。
(3)实验2中使用相同粒数催化剂微球的原因是______。
(4)通过对实验2数据的分析,可得出的结论是______。
(反思与评价)
(5)实验1是通过测量收集等体积O2所需时间来比较H2O2溶液的反应速率,还可以通过测量______来比较H2O2溶液的反应速率。
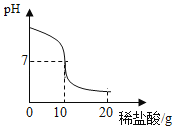
【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为4.0%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_____(精确到0.1%)
【题目】化学兴趣小组的同学通过查阅资料得知:过氧化氢分解除了二氧化锰作为催化剂,还可以用氧化铁、氧化铜等作为催化剂,于是他们开展了以下探究:
(探究(一))氧化铁能否做过氧化氢分解的催化剂?
项目 | 实验操作 | 实验现象 | 实验解释与结论 | |
解释 | 结论 | |||
实 验 一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是①_____ | 氧化铁是过氧化氢分解的催化剂 |
实 验 二 | 向盛有5mL5%过氧化氢溶液的试管中加入氧化铁,伸入带火星的木条 | ②_____ | 氧化铁能加快过氧化氢的分解 | |
(交流与反思)小岑同学认为仅由上述实验还不能得出表内的结论,他补充设计了两个方面的实验操作:第一方面的实验操作中包含了两次称量,其目的是探究反应前后氧化铁的③_____是否改变。第二方面的实验操作是利用“实验二”反应后试管内的固体剩余物继续实验,其目的是探究反应前后氧化铁的④_____是否改变。
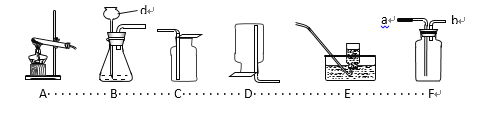
(探究(二))为了探究不同的催化剂对过氧化氢的催化效率,兴趣小组继续设计并进行了如下实验:
实验装置 | 实验编号 | 实验药品 | 收集10mL氧气的时间(s) |
| 1 | 5mL5%的过氧化氢溶液,0.5g二氧化锰 | 30 |
2 | 5mL10%的过氧化氢溶液,0.5g氧化铁 | 60 | |
3 | 5mL10%的过氧化氢溶液,0.5g氧化铜 | 20 |
(交流与反思)
(1)探究(二)与探究(一)实验方法相同,均属于⑤
(2)写出实验1的反应的化学方程式⑥_____;
(3)如图实验装置的连接顺序依次为:a→⑦_____→⑧_____→d(填接口字母);
(4)小茜根据表中数据分析得出结论:三者中氧化铜的催化效率最高,但是小诗却认为该结论并不可靠,理由是⑨_____;同学们根据小诗的建议重新设计并进行了实验,得出了正确的结论。