题目内容
【题目】某化学兴趣小组在实验室里进行木炭还原氧化铜的实验。
(实验1)装置如图。
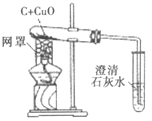
(1)木炭还原氧化铜的化学方程式为__,当碳与氧化铜的质量比为__(写最简整数比)时恰好完全反应。
(2)下列有关本实验的说法正确的是____(填字母)。
A 酒精灯加网罩以使火焰集中并提高温度
B 氧化铜发生了还原反应,木炭发生了氧化反应
C 观察到石灰水变浑浊即可证明氧化铜被还原了
D 反应后先撤出导气管,待试管冷却后再把其中的粉末倒出
(提出问题)实验1中,加热5分钟后仅能得到混有少量红色固体的黑色粉末。如何让木炭还原氧化铜时得到更多的铜呢?
(实验2)该小组同学在老师的指导下改进了实验,装置如图,加热2分钟后即得到紫红色有金属光泽的块状固体,且无黑色固体剩余。
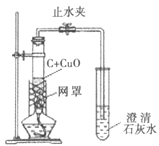
(1)刚烘干的木炭粉末与氧化铜粉末要在同一个研钵内充分研磨、混合均匀后再放入试管,这样做能使反应更充分,其主要原因是__。
(2)本实验所用的木炭与氧化铜的质量比为1︰10,碳需要略过量才能使氧化铜全部被还原,其主要原因是____。
(3)反应物放入试管后要尽量压实,并将试管竖直进行加热,使其下部完全被外焰包围,受热均匀,获得持续的高温。
(4)反应后关闭止水夹,让产物自然冷却,这时试管里残余的________就成了保护气。
(5)加了网罩的酒精灯火焰最高温度能达到800℃,而铜的熔点是1083℃。本实验获得了经熔化而成珠状或小块状的铜,可以推测木炭还原氧化铜的反应是________热量的。
(查阅资料)木炭还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
(拓展探究)将实验2得到的紫红色有金属光泽的块状固体全部研磨成粉末。
(1)将全部粉末放入烧杯中,加入足量稀硫酸,充分反应后,观察到______,证明实验2得到的铜中含有氧化亚铜;再经过滤、洗涤、干燥,得到纯净的单质铜1.52g。
(2)已知实验2使用的氧化铜粉末的质量为2.00g,不考虑实验过程中的损耗,则实验2得到的紫红色有金属光泽的块状固体中,单质铜的质量分数为______(计算结果保留一位小数)。
【答案】C+2CuO![]() 2Cu+CO2↑ 3︰40 ABD 增大了反应物的接触面积 有少量木炭会与试管中的氧气反应 二氧化碳 放出 溶液变蓝 88.9%
2Cu+CO2↑ 3︰40 ABD 增大了反应物的接触面积 有少量木炭会与试管中的氧气反应 二氧化碳 放出 溶液变蓝 88.9%
【解析】
(1) 木炭还原氧化铜的化学方程式为C+2CuO![]() 2Cu+CO2↑;故填写:
2Cu+CO2↑;故填写:
C+2CuO![]() 2Cu+CO2↑;
2Cu+CO2↑;
由木炭还原氧化铜的化学方程式可得,碳与氧化铜的质量比为:12:2 (64+16)=3:40;
(2)A、酒精灯加网罩以使火焰集中并提高温度,故符合题意;
B、氧化铜发生了还原反应,木炭发生了氧化反应,故符合题意;
C、观察到石灰水变浑浊不可证明氧化铜被还原了,因为在高温条件下,木炭与氧气也会反应生成二氧化碳,使澄清石灰水变浑浊,故不符合题意;
D、反应后先撤出导气管,待试管冷却后再把其中的粉末倒出,故符合题意
(3) 刚烘干的木炭粉末与氧化铜粉末要在同一个研钵内充分研磨、混合均匀后再放入试管,这样做能使反应更充分,其主要原因是增大了反应物的接触面积,故填写:增大了反应物的接触面积;
(4) 碳需要略过量才能使氧化铜全部被还原,其主要原因是有少量木炭会与试管中的氧气反应,故填写:有少量木炭会与试管中的氧气反应;
(5) 木炭还原氧化铜产生二氧化碳,反应后关闭止水夹,让产物自然冷却,这时试管里残余的二氧化碳就成了保护气,故填写:二氧化碳;
(6) 加了网罩的酒精灯火焰最高温度能达到800℃,而铜的熔点是1083℃。本实验获得了经熔化而成珠状或小块状的铜,可以推测木炭还原氧化铜的反应是放出热量的,故填写:放出;
(7) 氧化亚铜溶于稀硫酸会发生反应,生成硫酸铜,硫酸铜溶液为蓝色,故观察到溶液变蓝,证明实验2得到的铜中含有氧化亚铜,填写:溶液变蓝;
(8)解:设氧化亚铜与硫酸反应生成的铜的质量为x
Cu2O+H2SO4=CuSO4+Cu+H2SO4
144 160 64
![]()
![]() x
x
![]() 硫酸铜中铜的质量为:
硫酸铜中铜的质量为:![]() ⅹ
ⅹ![]() =x
=x
2.00g氧化铜中铜的质量为:2.00gⅹ![]() =1.6g
=1.6g
根据质量守恒定律的实质:化学反应前后元素质量不变的原则,故:x+1.52g=1.6g,x=0.08g
紫红色有金属光泽的块状固体中氧化亚铜的质量为:![]() =0.18g
=0.18g
紫红色有金属光泽的块状固体的质量为:0.18g+1.52g-0.08g=1.62g
单质铜的质量分数为:![]() ⅹ100%≈88.9%
ⅹ100%≈88.9%
答:实验2得到的紫红色有金属光泽的块状固体中,单质铜的质量分数为88.9%

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案