题目内容
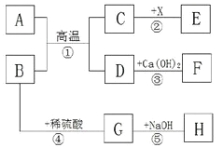
【题目】A、B、C、D、E、F、G都是初中化学中常见物质,A是白色固体,B和F是黑色固体,G和H是无色液体,E在D中燃烧的现象非常剧烈,火星四射。B在反应③中作催化剂。它们之间的转换关系如图所示:
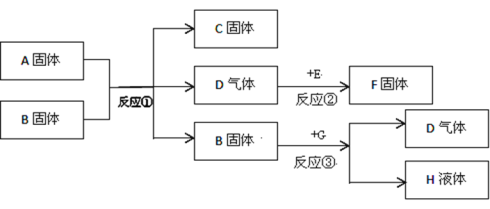
(1)写出上述物质的化学式:A________;G___________。
(2)写出上述①②③反应的化学方程式并在括号里注明该反应的基本反应类型。
①____________________ (____________)反应
②__________________________ (____________)反应
③____________________________________________
【答案】 KClO3 H2O2 2KClO3![]() 2KCl+3O2↑ 分解 3Fe+2O2
2KCl+3O2↑ 分解 3Fe+2O2![]() Fe3O4 化合 2H2O2
Fe3O4 化合 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
【解析】(1)A、B、C、D、E、F、G是初中化学常见的物质,E在D中燃烧的现象非常剧烈,火星四射,所以D有助燃性,D是氧气,铁和氧气点燃生成四氧化三铁,所以E是铁,F是四氧化三铁,A是白色固体,B和F是黑色固体,G和H是无色液体,A和B、B和G都会生成氧气,所以A是氯酸钾,G是过氧化氢溶液,氯酸钾分解生成氯化钾和氧气,所以C是氯化钾,过氧化氢分解生成水和氧气,所以H是水,经过验证,推导正确,所以A是KClO3,G是H2O2;(2)反应①是氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑,此反应属于分解反应;反应②是铁和氧气在点燃的条件下生成四氧化三铁,化学方程式为:3Fe+2O2
2KCl+3O2↑,此反应属于分解反应;反应②是铁和氧气在点燃的条件下生成四氧化三铁,化学方程式为:3Fe+2O2![]() Fe3O4,此反应属于化合反应;反应③是过氧化氢分解生成水和氧气,化学方程式为:2H2O2
Fe3O4,此反应属于化合反应;反应③是过氧化氢分解生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】下列是电解水反应示意图和装置。示意图①~③中,“●”表示氢原子,“O”表示氧原子。
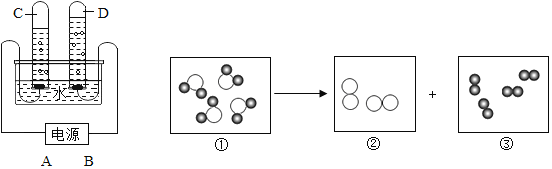
(1)图中表示化合物的是_____,表示单质的是_____(用序号填空)。
(2)②所代表的物质是左图中试管(填字母)_____中产生的气体,图中A是电源的_____(填“正”或“负”)极。
(3)为了探究C和D玻璃管分别产生的是什么气体,用燃着的木条分别在两个玻璃管口检验电解反应中产生的气体,观察并记录发生的现象,请填写下表:
C玻璃管 | D玻璃管 | |
现象 | _____ | _____ |
解释 | _____ | _____ |
(4)写出图中反应的化学符号表达式:_____。