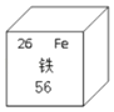
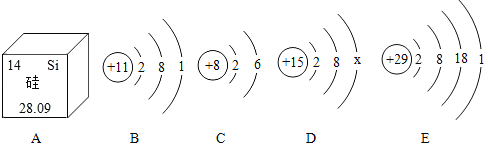题目内容
【题目】有一包金属粉末,可能由Mg、Al、Zn、Fe中的一种或几种组成。向2.4g该金属粉末中加入100g稀硫酸,充分反应,生成0.2g H2,金属无剩余。下列说法正确的是
A. 金属粉末中一定含有MgB. 金属粉末中一定含有Al
C. 金属粉末中可能含有四种金属D. 稀硫酸的质量分数为9.8%
【答案】C
【解析】
A、样品中等质量的金属与稀硫酸反应生成的氢气铝比镁多,等质量的铁、锌比镁生成的氢气少,故可能是铁与铝或是锌与铝的混合物,不符合题意;
B、2.4gMg完全反应产生的氢气质量恰好是0.2g,故可能是纯净物镁,不符合题意;
C、样品中等质量的金属,Mg与稀硫酸反应产生的氢气为0.2g,Al与稀硫酸反应产生的氢气大于0.2g,Zn、Fe与稀硫酸反应产生的氢气小于0.2g,根据平均值法,金属粉末中可能含有四种金属,故符合题意;
D、当稀硫酸恰好完全反应时,生成氢气的质量为0.2g,含0.2g的氢元素的硫酸的质量为0.2g![]() =9.8g,故硫酸的质量分数为
=9.8g,故硫酸的质量分数为![]() ⅹ100%=9.8%,但题中未说明稀硫酸是否完全反应,故不符合题意
ⅹ100%=9.8%,但题中未说明稀硫酸是否完全反应,故不符合题意

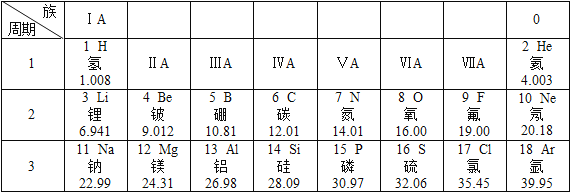
【题目】如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入广口瓶中,振荡,一段时间后可见小气球a膨胀鼓起。下表中的各组物质不会出现上述现象的是( )
X | Y | |
A | CO | Ca(OH)2溶液 |
B | CO2 | NaOH溶液 |
C | HCl | Ca(OH)2溶液 |
D | SO2 | NaOH溶液 |
A. AB. BC. CD. D
【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
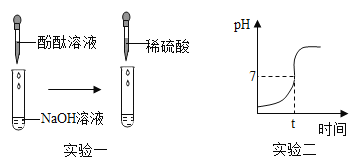
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。