题目内容
【题目】化学兴趣小组的同学通过查阅资料得知:过氧化氢分解除了二氧化锰作为催化剂,还可以用氧化铁、氧化铜等作为催化剂,于是他们开展了以下探究:
(探究(一))氧化铁能否做过氧化氢分解的催化剂?
项目 | 实验操作 | 实验现象 | 实验解释与结论 | |
解释 | 结论 | |||
实 验 一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是①_____ | 氧化铁是过氧化氢分解的催化剂 |
实 验 二 | 向盛有5mL5%过氧化氢溶液的试管中加入氧化铁,伸入带火星的木条 | ②_____ | 氧化铁能加快过氧化氢的分解 | |
(交流与反思)小岑同学认为仅由上述实验还不能得出表内的结论,他补充设计了两个方面的实验操作:第一方面的实验操作中包含了两次称量,其目的是探究反应前后氧化铁的③_____是否改变。第二方面的实验操作是利用“实验二”反应后试管内的固体剩余物继续实验,其目的是探究反应前后氧化铁的④_____是否改变。
(探究(二))为了探究不同的催化剂对过氧化氢的催化效率,兴趣小组继续设计并进行了如下实验:
实验装置 | 实验编号 | 实验药品 | 收集10mL氧气的时间(s) |
| 1 | 5mL5%的过氧化氢溶液,0.5g二氧化锰 | 30 |
2 | 5mL10%的过氧化氢溶液,0.5g氧化铁 | 60 | |
3 | 5mL10%的过氧化氢溶液,0.5g氧化铜 | 20 |
(交流与反思)
(1)探究(二)与探究(一)实验方法相同,均属于⑤
(2)写出实验1的反应的化学方程式⑥_____;
(3)如图实验装置的连接顺序依次为:a→⑦_____→⑧_____→d(填接口字母);
(4)小茜根据表中数据分析得出结论:三者中氧化铜的催化效率最高,但是小诗却认为该结论并不可靠,理由是⑨_____;同学们根据小诗的建议重新设计并进行了实验,得出了正确的结论。
【答案】反应速率很慢 有大量气泡产生,木条复燃 质量 化学性质 对比实验(或控制变量) 2H2O2![]() 2H2O+O2↑ b c 实验1中所用的过氧化氢溶液的浓度与另两个实验不同,无法进行比较
2H2O+O2↑ b c 实验1中所用的过氧化氢溶液的浓度与另两个实验不同,无法进行比较
【解析】
[探究(一)]实验一:取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条,观察到有气泡产生,木条不复燃,说明过氧化氢分解产生氧气,但是分解速率很慢;
实验二:向盛有5mL5%过氧化氢溶液的试管中加入氧化铁,伸入带火星的木条,因为氧化铁能加快过氧化氢的分解,所以会观察到有大量气泡产生,木条复燃;
[交流与反思]由催化剂的概念可知,催化剂不但能改变化学反应的速率,而且其质量与化学性质在化学反应前后保持不变,所以应补充设计以下两个方面的实验操作:第一方面的实验操作中包含了两次称量,其目的是探究反应前后氧化铁的质量是否改变;第二方面的实验操作是利用“实验二”反应后试管内的固体剩余物继续实验,其目的是探究反应前后氧化铁的化学性质是否改变;
[探究(二)](1)探究(二)与探究(一)实验方法相同,均属于对比实验或控制变量法;(2)实验1发生的反应是过氧化氢在二氧化锰的催化作用下分解为水和氧气;反应的化学方程式:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)第一个装置制取氧气,产生氧气的导管连接第二个装置的短导管,长管排出的水进入量筒内,量筒内水的体积即为收集的氧气体积;
(4)实验1中所用的过氧化氢溶液的浓度与另两个实验不同,无法进行比较,所以该结论并不可靠。

【题目】某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。
(査阅资料)硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
(实验与探究)
内容 | 现象 | 实验解析 | 结论 | |
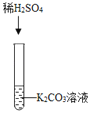
实验一 |
| ①_____ | 化学方程式是:K2CO3+H2SO4═K2SO4+H2O+CO2↑ | 生成物中有气体或有④___或有沉淀生成时,复分解反应可以发生。 |
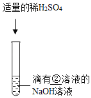
实验二 |
②_____ | 溶液颜色由红色恰好变为无色 |
③_____ | |
实验三 |
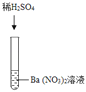
| 产生白色沉淀 | 该反应的实质是:Ba2++SO42﹣═BaSO4↓ |
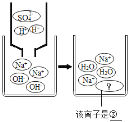
实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是_____。
(拓展与应用)将稀盐酸Ca(OH)2溶液NaCl溶液Na2CO3溶液任意两种溶液相混合,能发生反应的共有_____组。