题目内容
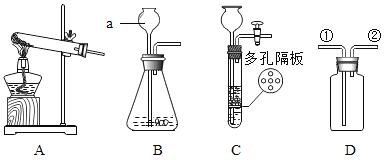
【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验.
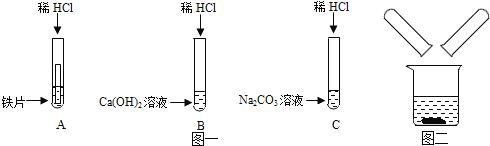
(1)写出A试管中的反应现象_____.
(2)写出B试管中反应的化学方程式_____.
(3)实验结束后,小组同学将_____两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到先有气泡产生,后有白色沉淀生成.同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究.
(提出猜想)
甲同学猜想:NaCl; 乙同学猜想:NaCl、CaCl2;
丙同学猜想:NaCl、CaCl2、HCl; 你的猜想:_____.
(交流讨论)
你认为_____同学的猜想一定不正确,理由是_____.
(设计实验)请设计实验证明你的猜想正确.
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加_____ | _____ | 猜想成立 |
【答案】铁片表面有气泡产生,溶液由无色逐渐变为浅绿色 Ca(OH)2+2HCl=CaCl2+2H2O B、C NaCl、Na2CO3 丙 白色沉淀是碳酸钙,能与盐酸反应,二者不能共存 无色酚酞试液 无色酚酞试液变红
【解析】
(1)根据铁和稀盐酸的反应分析A试管中的现象;
(2)根据氢氧化钙和稀盐酸反应写出反应方程式;
(3)根据反映的现象分析可能混合的试管;
[提出猜想]根据反应的量分析滤液的溶质成分;
[交流讨论]根据碳酸钙和稀盐酸反应分析错误的猜想;
[设计实验]根据碳酸钠溶液显碱性,能使酚酞试液变红设计实验;
(1)因为铁与稀盐酸的反应生成了氯化亚铁和氢气,所以A试管中的反应现象是铁片表面产生气泡,溶液由无色变为浅绿色。故答案为:铁片表面有气泡产生,溶液由无色逐渐变为浅绿色;
(2)在B试管中氢氧化钙和盐酸反应生成了氯化钙和水。故答案为:Ca(OH)2+2HCl=CaCl2+2H2O;
(3)由实验的现象可以知道,混合后的溶液先产生气泡,说明在C中有剩余的碳酸钠,另一只试管中有剩余的盐酸,后有白色沉淀生成,沉淀应为碳酸钙,说明溶液含有氯化钙,由此可以知道应该是B、C试管的混合。故答案为:B、C;
[提出猜想]有上述分析可知,当碳酸钠与盐酸、氯化钙恰好反应时,滤液中只有氯化钠和氯化钙,当碳酸钠剩余时,滤液中含有氯化钠和碳酸钠。所以我的猜想是:NaCl、Na2CO3。故答案为:NaCl、Na2CO3;
[交流讨论]因为白色沉淀是碳酸钙,能与稀盐酸反应,二者不能共存,所以丙同学猜想不成立。故答案为:丙、白色沉淀是碳酸钙,能与盐酸反应,二者不能共存;
[设计实验]因为碳酸钠溶液显碱性,能使酚酞试液变红,所以利用无色酚酞试液进行验证。故答案为:无色酚酞试液、无色酚酞试液变红。

【题目】妈妈买来一瓶管道通,商品标识如下表:
| 商品名 | 固体管道疏通剂 |
主要成分 | 氢氧化钠60% 碳酸钠15% | |
注意事项 | 不要与皮肤接触 | |
含量 | 600g |
小明欲测定标识中碳酸钠的含量是否属实,做了以下实验:取10g管道通样品,加入足量水,待完全冷却后滤去不溶物。向滤液中加入足量的氯化钙溶液,待完全反应后,过滤,洗涤、烘干,称量沉淀质量为2g,(假设管道通其他成分不参加化学反应)。请通过计算说明碳酸钠的标识是否属实___(请写出计算过程)
【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与镁条接触的物质,利用下图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水再通入约4mL CO2 | 镁条第3天开始变黑至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是 (用化学方程式表示)。
(2)实验1的目的是 。
(3)实验3中,试管内的气体主要含有CO2、 。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是 (填编号)。
(5)由上述实验可推知,镁条变黑的条件是 。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是 。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是 。