题目内容
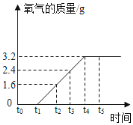
【题目】化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取用20g石灰石样品,进行高温煅烧(样品中除碳酸钙外,其余成分高温不分解。碳酸钙分解的化学方程式为CaCO3 == CaO + CO2↑),不同时间测得剩余固体的质量如下表所示:
煅烧的时间(min) | 剩余固体的质量(g) |
2 | 17.8 |
4 | 13.4 |
6 | 12.3 |
8 | 12.3 |
(1)完全反应后生成二氧化碳的质量_____________。
(2)求石灰石样品中碳酸钙的质量分数_______
【答案】7.7g 87.5%
【解析】
(1)根据质量守恒定律,反应前后减少的质量就是二氧化碳的质量。由表可知6分钟时碳酸钙已经完全分解。故二氧化碳的质量=20-12.3=7.7g;
(2)根据二氧化碳的质量计算出碳酸钙的质量,设碳酸钙的质量为X
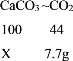
X=17.5g
碳酸钙的质量分数=17.5÷20×100%=87.5%

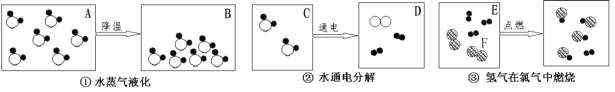
【题目】金属材料广泛应用于生产生活中。
(l)铝块能制成铝箔是利用了铝的_________性(填“导电”或“延展”);铝的“自我保护”原因是___________。(用化学方程式表示)
(2)小张利用图示装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置略)
查阅资料:Fe3O4在常温下能与稀盐酸反应,方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,不与CuSO4溶液反应。
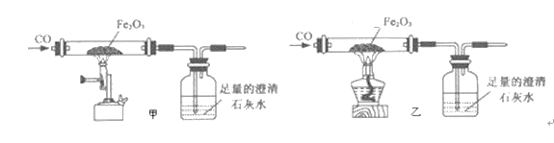
A.实验开始时应先通CO,目的是:___________;
B.从环保角度考虑,图示装置还应采取的改进措施是__________。
C.两实验过程中,澄清石灰水均变浑浊,发生的化学反应方程式为:_________,完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末,用磁铁吸引 | 能被吸引 | 能被吸引 |
2 | 取黑色粉末,加入稀盐酸 | 全部溶解,有大量气泡 | 无气泡产生 |
3 | 取黑色粉末,加入足量CuSO4溶液 | 有红色物质产生 | 无明显现象 |
①甲组的黑色粉末与稀盐酸反应的化学方程式是_________。
②根据实验现象,乙组实验玻璃管中发生的反应方程式为:__________。
③甲、乙两组实验说明温度对CO和Fe2O3反应____________(填有、无或不确定)影响。
(3)小兰对黄铜(Cu – Zn合金)中的Zn的含量进行了探究,将4.0g黄铜粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应,测得烧杯中剩余物质的质量为13.96g, 则:
①生成氢气的质量是_________g;
②若不考虑该合金中除Cu、Zn以外的其他成分,请计算原Cu – Zn合金中Zn的质量分数_______。(计算结果精确到小数点后一位)
【题目】利用下表中的装置进行实验。有关该实验说法不正确的是( )
实验装置 | 实验步骤 |
| ①将a试管充满二氧化碳,b试管加入紫色石蕊溶液(K处于关闭状态) ②密闭下,用针筒将a试管中部分二氧化碳抽出 |
A. 用针筒将部分二氧化碳抽出,a试管中气体分子间间隔变大
B. 打开K,b试管中的液体颜色变红
C. 打开K,导管E内液面上升
D. 打开K,发生反应:H2O+CO2==H2CO3