题目内容
【题目】高级轿车常配置一种汽车安全气囊,其内部贮有硝酸铵(NH4NO3),当汽车受到猛烈撞击时,安全气囊会在瞬间弹出,防止驾驶员受伤。撞车时,约在0.01 s内引发安全气囊内下列反应:NH4NO3 =N2O↑+2H2O。
(1)此反应中反应物和生成物中的氮元素化合价从左到右依次为 ___________。
(2)若有40g硝酸铵完全反应,产生N2O的质量是多少_________?
【答案】-3、+5、+1 22g。
【解析】
硝酸铵中N元素化合价分别为-3,+5,一氧化二氮中N元素化合价为+1,;
设产生N2O的质量为x g,由化学式:![]() 可知,硝酸铵的相对分子质量为80,一氧化二氮的相对分子质量为44,则产生一氧化二氮的质量x=44*40/80=22g。
可知,硝酸铵的相对分子质量为80,一氧化二氮的相对分子质量为44,则产生一氧化二氮的质量x=44*40/80=22g。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
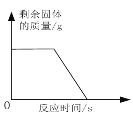
【题目】化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取用20g石灰石样品,进行高温煅烧(样品中除碳酸钙外,其余成分高温不分解。碳酸钙分解的化学方程式为CaCO3 == CaO + CO2↑),不同时间测得剩余固体的质量如下表所示:
煅烧的时间(min) | 剩余固体的质量(g) |
2 | 17.8 |
4 | 13.4 |
6 | 12.3 |
8 | 12.3 |
(1)完全反应后生成二氧化碳的质量_____________。
(2)求石灰石样品中碳酸钙的质量分数_______