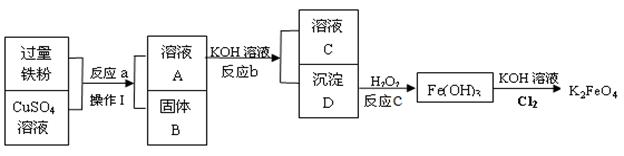
题目内容
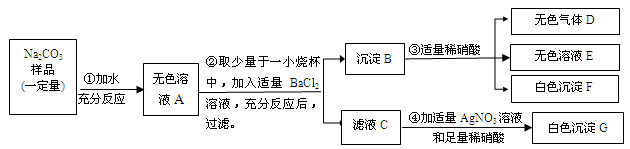
(7分)某固体NaOH样品可能混入Na2CO3、Na2SO4、(NH4)2SO4中的一种或几种,现按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。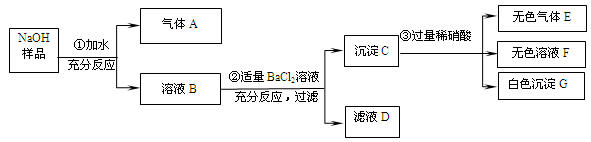
试根据实验过程和发生的现象回答下列问题:
气体A能使无色酚酞变为________________色。
滤液D中的溶质为_____________________________。
写出步骤②中发生的一个方程式__________________________________。
通过上述实验证明混进的物质一定有_____________________。
不能确定该样品中是否含有____________。
⑴红 ⑵NaCl ⑶ Na2SO4+BaCl2 BaSO4↓+2NaCl或Na2CO3+BaCl2 Ba CO3↓+2NaCl
⑷Na2CO3 (NH4)2SO4
⑸Na2SO4
解析试题分析:氢氧化钠中混有的杂质都溶于水,但只有铵根离子能与氢氧根离子反应会生成氨气,氨气溶于水形成氨水,氨水呈碱性,能使无色酚酞变红色,所以混进的物质一定含有硫酸铵;碳酸根离子、硫酸根离子会与钡离子生成白色的碳酸钡沉淀、硫酸钡沉淀,碳酸钡沉淀会与酸反应生成二氧化碳气体,但硫酸钡不溶于酸,故沉淀C中含有碳酸钡和硫酸钡;所以混进的物质中一定含有碳酸钠,由于硫酸铵中也含有硫酸根离子,所以不能判断混进的物质中是否含有硫酸钠。
考点:物质的推断

 阅读快车系列答案
阅读快车系列答案某化学学习小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动。
(1)该反应的化学方程式为_______________________________________。
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③____________________________。
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况________(填序号)是不可能的。
为了进一步确定溶液的成分,同学们设计了如下实验方案:
| 实验步骤 | 现 象 | 结 论 |
| | | 情况①正确 |
小红选择了另外一种不同类别的物质________________________________(填化学式),也得到了同样的结论。在同学们的合作下,他们顺利完成了探究任务。
某同学做了如下图所示的实验,在14.6%的稀盐酸中加入碳酸钙,后加入10.6%的碳酸钠溶液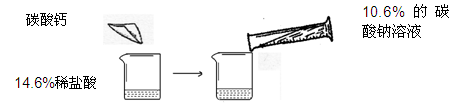
| | 第一次 | 第二次 |
| 14.6%的稀盐酸的质量 | m | m |
| 加入碳酸钙的质量 | 10g | 20g |
| 加入10.6%的碳酸钠溶液的质量 | 100g | 200g |
| 加入碳酸钠溶液后,实验现象 | 只有气泡 | 只有白色沉淀 |
写出实验一中发生化学反应的方程式
第一次实验中加入碳酸钙后溶液中溶质成分
根据已知条件列出求解第二次实验生成沉淀的质量的比例式
实验中加入稀盐酸m的质量为
若将第二次反应后的溶液蒸发191.2g水,则所得不饱和溶液中溶质的质量分数为
若用溶质质量分数29.2%的浓盐酸配置实验所需的稀盐酸,则需要加水的质量
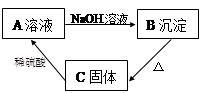
 B_____________________。
B_____________________。