题目内容
【题目】兴趣小组的同学对金属的某些性质进行相关探究。
(实验回顾)
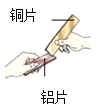
(1)如图所示,将两块金属片进行相互刻划。该实验的目的是_____。
(2)用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,轻轻摇晃,发现熔化的铝不滴落,好像有一层膜兜着(资料:铝的熔点660℃,氧化铝的熔点2054℃。)。请解释原因_____。
(实验探究)铝与氯化铜溶液的反应

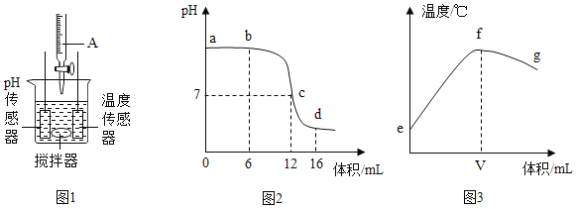
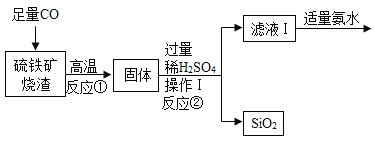
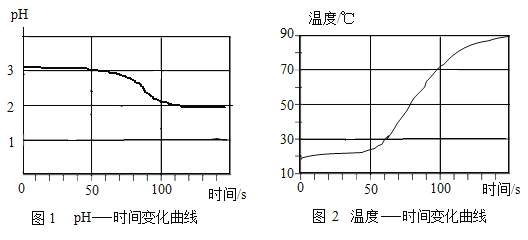
将打磨过的铝片放在15%氯化铜溶液中,观察到铝片表面逸出大量无色气体,且附着红色物质,过一段时间还有白色沉淀产生。利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示)。
(实验反思)
(1)写出生成红色物质的化学方程式为_____。
(2)结合图1分析,铝和氯化铜溶液反应生成的无色气体是_____(填名称)。
(提出问题)白色沉淀的化学成分是什么?
(查阅资料)
①氢氧化铝、氯化亚铜(CuCl)均是难溶于水的白色固体。
②CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl—。
③Cu(NH3)2+在空气中易被氧化变为蓝色;Cl—可与硝酸银溶液反应,产生白色沉淀。
(实验方案)将上述实验中产生的沉淀过滤出来,并洗涤干净后,加入浓氨水,沉淀部分溶解得到无色溶液,将无色溶液分为两份,进行实验。
操作步骤 | 实验现象 | 实验结论 |
用试管取其中一份溶液,滴加适量AgNO3溶液 | _____ | 该溶液中含有Cl— |
将另一份溶液置于空气中一段时间 | _____ | 该溶液中含有Cu(NH3)2+ |
(实验结论)通过实验可以确定,该白色固体是CuCl。
(反思与评价)
(1)小组同学将Cu粉与15%CuCl2溶液混合,没有观察到白色沉淀。在老师的启发下,结合图2“温度-时间变化曲线”,对实验进行改进,确证了Cu与CuCl2溶液反应生成CuCl。请你写出改进后的实验方案是_____。
(2)经过讨论CuCl是Cu与CuCl2化合反应生成。
(思维拓展)
(1)金属锌、铜和稀硫酸构成化学电池(如图)。观察到铜片表面有气泡(H2),小电珠发光、烧杯中溶液始终无色。下列关于实验的分析不正确的是_____(填序号)。
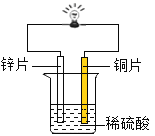
A 铜与稀硫酸发生了置换反应
B 铜的金属活动性变得比锌强
C 烧杯中溶液的pH会逐渐增大
D 该装置将电能转化为化学能
(2)某工厂化验室用20%NaOH溶液来中和上图实验前烧杯中的H2SO4,共消耗NaOH溶液20g,反应后的溶液呈中性,则上图烧杯中原来所含H2SO4的质量为_____(写出计算过程)。
【答案】比较硬度 氧气和铝生成了一层致密的氧化铝氧化膜,氧化铝的熔点高于铝。 2Al+3CuCl2=3Cu+2AlCl3 氢气 生成白色沉淀 溶液变为蓝色 加热观察是否产生白色沉淀,若加热沉淀出现说明Cu与CuCl2反应生成CuCl,若不产生沉淀说明Cu不与CuCl2反应生成CuCl。 ABD 4.9g(详见解析)
【解析】
[实验回顾]}
(1)如图所示,将两块金属片进行相互刻划目的比较其硬度,故填:比较硬度。
(2)氧气和铝生成了一层致密的氧化铝氧化膜,氧化铝的熔点高于铝。故用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,发现熔化的铝不滴落,好像有一层膜兜着,故填:氧气和铝生成了一层致密的氧化铝氧化膜,氧化铝的熔点高于铝。。
[实验反思]
(1)铝和氯化铜反应生成氯化铝和红色铜,化学方程式为;2Al+3CuCl2=3Cu+2AlCl3,故填:2Al+3CuCl2=3Cu+2AlCl3。
(2)溶液pH小于7呈酸性,铝和酸反应生成氢气,故生成的气体为氢气,故填:氢气。
[实验方案]溶液中含有Cl-,滴加适量AgNO3溶液会生成白色沉淀,溶液中含有Cu(NH3)2+置于空气中一段时间会变为蓝色,故填:生成白色沉淀;溶液变为蓝色。
[反思与评价]通过图2“温度-时间变化曲线”发现加入铝片之后溶液温度升高,猜想加热Cu与CuCl2反应生成CuCl,可以加热观察是否产生白色沉淀,若加热沉淀出现说明Cu与CuCl2反应生成CuCl,若不产生沉淀说明Cu不与CuCl2反应生成CuCl,故填:加热观察是否产生白色沉淀,若加热沉淀出现说明Cu与CuCl2反应生成CuCl,若不产生沉淀说明Cu不与CuCl2反应生成CuCl。
{思维拓展}
A、在金属活动顺序中,铜排在氢之后,铜与稀硫酸不反应,故A错误;
B、在金属活动顺序中,锌排在铜之前,锌的金属活动性比铜强,故B错误;
C、烧杯中溶液的氢离子生成氢气,酸性减弱,pH会逐渐增大,C正确;
D、该装置将化学能转化为电能,D错误。
故选:ABD。
(2)设H2SO4质量为x。

答:质量为4.9g

 阅读快车系列答案
阅读快车系列答案【题目】黄铜是铜和锌的合金![]() ,为了测定黄铜样品中锌的质量分数,现将80g稀硫酸平均分成4份,分别与一定质量的黄铜样品进行实验,每次充分反应后,测定生成氢气的质量数据如下表:
,为了测定黄铜样品中锌的质量分数,现将80g稀硫酸平均分成4份,分别与一定质量的黄铜样品进行实验,每次充分反应后,测定生成氢气的质量数据如下表:
实验次数 | 一 | 二 | 三 | 四 |
黄铜样品质量/g | 1 | 2 | 3 | 4 |
生成氢气质量/g | 0.02 | 0.04 | 0.05 | M |
(1)从第_____次实验开始黄铜样品有剩余;
(2)M=_____;
(3)黄铜样品中锌的质量分数?_____(写出具体的计算过程![]()