题目内容
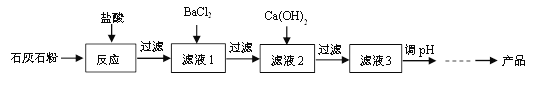
【题目】Ⅰ.高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:
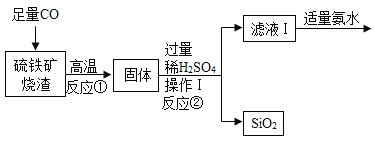
(1)操作Ⅰ和操作Ⅱ都要用到的玻璃棒,玻璃棒的作用是____________。
(2)反应②的化学方程式是____________________。
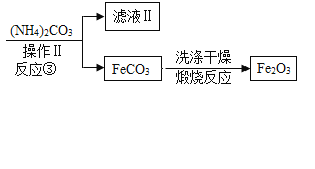
(3)反应③的基本反应类型是________________。
(4)检验滤液Ⅱ中阳离子的操作是:取样,滴加______________________溶液,微热,将湿润的红色石蕊试纸放在试管口。
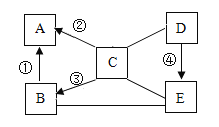
Ⅱ.下图表示元素的化合价与物质类别的关系,“→”表示物质之间可以转化。A、B、C、D、E 是初中化学所学物质,分别由 Fe、H、O、Cl 中的一种、两种或三种元素组成,已知:难溶性碱加热时会生成对应的氧化物。

(1)Ⅰ题中的产物 Fe2O3 是上图中的___________物质(填序号)。
(2)B→A 的转化对应Ⅰ题中的反应___________(填序号)。
(3)C→B 的另一种生成物的化学式是__________。
(4)除了图中所示的转化关系外, 还存在哪些转化关系, 请写出对应的化学方程式___________________________。
【答案】引流 ![]() 复分解反应 NaOH B ① H2O
复分解反应 NaOH B ① H2O ![]()
【解析】
Ⅰ.(1)实验室中,步骤Ⅰ、步骤Ⅱ中实现固液分离的操作为过滤,过滤中玻璃棒的作用是引流;
(2)反应②是铁硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为![]() ;
;
(3)反应③是碳酸铵与硫酸亚铁反应生成碳酸亚铁和硫酸铵,此反应是由两种化合物相互交换成分反应生成两种化合物的反应,属于复分解反应;
(4)滤液Ⅱ中的阳离子是铵根离子,方法是:取样于试管中,加入NaOH溶液,微热,将润湿的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝色,说明氯化铵溶液中铵根离子;
Ⅱ. (1)Ⅰ题中的产物 Fe2O3中的氧元素显+2价,根据化合物中正负化合价代数和为零,可知铁显+3价,故对应B;
(2)B→A 是氧化铁转化为单质铁,Ⅰ题中的反应①是利用一氧化碳将铁从铁矿石中还原出来;
(3)C是碱,根据提供的元素,只能是氢氧化铁,氢氧化铁在加热条件下生成氧化铁和水,化学式为H2O;
(4)B→D是氧化铁和盐酸反应生成氯化铁和水,反应的化学方程为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】兴趣小组的同学对金属的某些性质进行相关探究。
(实验回顾)
(1)如图所示,将两块金属片进行相互刻划。该实验的目的是_____。
(2)用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,轻轻摇晃,发现熔化的铝不滴落,好像有一层膜兜着(资料:铝的熔点660℃,氧化铝的熔点2054℃。)。请解释原因_____。
(实验探究)铝与氯化铜溶液的反应

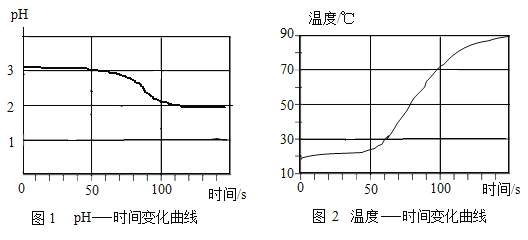
将打磨过的铝片放在15%氯化铜溶液中,观察到铝片表面逸出大量无色气体,且附着红色物质,过一段时间还有白色沉淀产生。利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示)。
(实验反思)
(1)写出生成红色物质的化学方程式为_____。
(2)结合图1分析,铝和氯化铜溶液反应生成的无色气体是_____(填名称)。
(提出问题)白色沉淀的化学成分是什么?
(查阅资料)
①氢氧化铝、氯化亚铜(CuCl)均是难溶于水的白色固体。
②CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl—。
③Cu(NH3)2+在空气中易被氧化变为蓝色;Cl—可与硝酸银溶液反应,产生白色沉淀。
(实验方案)将上述实验中产生的沉淀过滤出来,并洗涤干净后,加入浓氨水,沉淀部分溶解得到无色溶液,将无色溶液分为两份,进行实验。
操作步骤 | 实验现象 | 实验结论 |
用试管取其中一份溶液,滴加适量AgNO3溶液 | _____ | 该溶液中含有Cl— |
将另一份溶液置于空气中一段时间 | _____ | 该溶液中含有Cu(NH3)2+ |
(实验结论)通过实验可以确定,该白色固体是CuCl。
(反思与评价)
(1)小组同学将Cu粉与15%CuCl2溶液混合,没有观察到白色沉淀。在老师的启发下,结合图2“温度-时间变化曲线”,对实验进行改进,确证了Cu与CuCl2溶液反应生成CuCl。请你写出改进后的实验方案是_____。
(2)经过讨论CuCl是Cu与CuCl2化合反应生成。
(思维拓展)
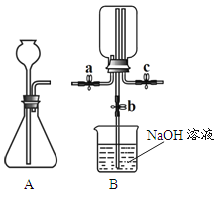
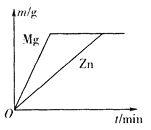
(1)金属锌、铜和稀硫酸构成化学电池(如图)。观察到铜片表面有气泡(H2),小电珠发光、烧杯中溶液始终无色。下列关于实验的分析不正确的是_____(填序号)。
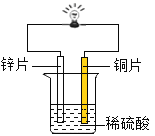
A 铜与稀硫酸发生了置换反应
B 铜的金属活动性变得比锌强
C 烧杯中溶液的pH会逐渐增大
D 该装置将电能转化为化学能
(2)某工厂化验室用20%NaOH溶液来中和上图实验前烧杯中的H2SO4,共消耗NaOH溶液20g,反应后的溶液呈中性,则上图烧杯中原来所含H2SO4的质量为_____(写出计算过程)。
【题目】实验室有一份在空气中潮解部分变质的氢氧化钠样品,质量为1.86g。某实验小组将这份样品完全溶解,配成 50g 溶液,然后缓慢滴入 7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液 pH 和溶液总质量,部分数据如下表所示:
测量次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 |
滴加的盐酸总质量/g | 0 | 5 | 20 | 30 | 35 |
溶液总质量/g | 50 | 55 | 69.56 | 79.56 | 84.56 |
溶液 pH | 12.4 | 12.1 | 7.0 | 2.2 | 2.1 |
请分析计算:
(1)氢氧化钠变质是与空气中的_________________反应。
(2)实验中生成二氧化碳的质量为___________________g。
(3)求样品中氢氧化钠的质量___________________。
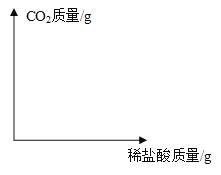
(4)请在下图中画出稀盐酸质量与二氧化碳质量关系的图像___________________(温馨提醒:标出关键点的数据)。
(5)当恰好完全反应时,该溶液的溶质质量分数是_________。(结果保留一位小数)。