题目内容
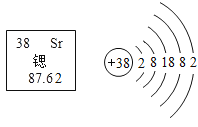
【题目】今年是门捷列夫发现化学元素周期表150周年,第74次联合国大会宣布2019年为“国际化学元素周期表年”。下表为部分元素的原子结构示意图,请回答问题。
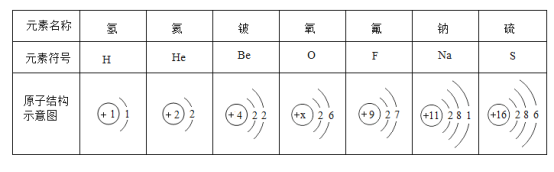
(1).上表所列的 7种元素中,位于第二周期的元素有_____种。
(2)氧原子得到电子所形成离子的离子符号为_____。
(3) 11 号与16号两种元素组成的化合物,其化学式为_____。
(4)金属铍(Be) 与铝化学性质相似,在空气中,铍的表面易形成一层氧化物保护膜,发生反应的化学方程式为_____。
【答案】3 O2- Na2S 2Be+O2=2BeO
【解析】
(1)原子的所在周期与其电子层数相同,上表所列的7种元素中,位于第二周期的元素有3种,即铍元素、氧元素、氟元素。
故填:3。
(2)氧原子的最外层电子数为6,容易得到2个电子所形成带2个单位负电荷的O2-。
故填:O2-。
(3)11号(钠元素)与16号(硫元素)两种元素组成的化合物是硫化钠,硫化钠中钠元素化合价是+1,硫元素化合价是-2,根据化合物中元素化合价代数和为零可知,硫化钠化学式是Na2S。
故填:Na2S。
(4)在空气中,铍和氧气反应生成氧化铍,发生反应的化学方程式为:2Be+O2=2BeO。
故填:2Be+O2=2BeO。

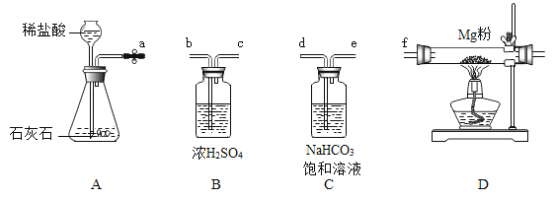
【题目】同学们对“影响金属与盐酸反应剧烈程度的因素”进行了探究。
[提出问题]金属与盐酸反应剧烈程度受哪些因素影响?
[做出猜想] Ⅰ.与盐酸的浓度有关Ⅱ .与____________有关Ⅲ.与金属的种类有关
[进行实验]
实验编号 | 金属 | 盐酸的质量分数% | 温度℃ | 金属丝消失的时间s |
① | 铝丝 | 5 | 20 | 450 |
② | 铝丝 | 8 | 20 | t |
③ | 铝丝 | 10 | 20 | 240 |
④ | 铝丝 | 10 | 30 | 65 |
⑤ | 铁片 | 10 | 30 | 125 |
[解释与结论]
(1)补充猜想:金属与盐酸反应剧烈程度,与____________有关。
(2)铝与盐酸反应的方程式为_________________。
(3)由实验①③可知,猜想1___________。(填“成立”或“不成立”)。在实验②中,铝丝消失的时间(用t表示)的取值范围是_________________。
(4)有同学认为通过实验④⑤并不能证明“猜想与假设Ⅲ”成立,理由是_________________。
【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:)
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)原混合物中碳酸钙与氯化钙的质量比为_____________;
(2)求表中m的值____________ (要求写出完整的过程)。