��Ŀ����
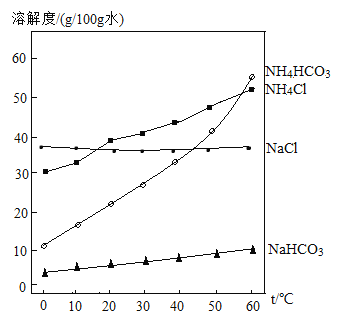
����Ŀ��ij��ѧѧϰС��������������Ȼ�����Һ�����Ȼ��ƺ�̼��������ʵ��Է�Һ������Һ�����ʳɷֽ�����̽�������������̽����
��������⣩
��Һ������Һ��������ʲô��
���������룩
I.��Ϊ�Ȼ��ƣ�
��.______��
��.�Ȼ��ƺ�̼���ƣ�
����Ʒ�����
ʵ����� | ���� | ���� |
ȡ������Һ�����ϲ���Һ�������м���һ������____��Һ���ѧʽ������һ�֣� | ���������� | �������ȷ |
�а�ɫ�������� | �������ȷ | |
________ | �������ȷ |
��������˼��
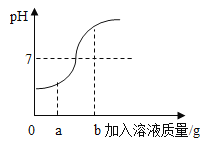
ѧϰС�龭��������Ϊ�����п����Ա��εķ�Һ�������������̼������Һ��������д���Ȼ�����̼���Ʒ�Ӧ�Ļ�ѧ����ʽ___________����ַ�Ӧ����ҺpH__7������>������<������=��������ʱ��Һ�д��ڵ�������______��
���𰸡�.�Ȼ��ƺ��Ȼ�������NaCl��BaCl2�� H2SO4 �����ݲ��� ![]() > Na+��Cl-��CO32-
> Na+��Cl-��CO32-
��������
[��������]I���Ȼ�����̼����ǡ����ȫ��Ӧʱ��Ϊ�Ȼ��ƣ�
���Ȼ�������ʱ���Ȼ��ƺ��Ȼ�����
��̼���ƹ���ʱ���Ȼ��ƺ�̼���ơ�
����Ȼ��ƺ��Ȼ�����
[��Ʒ���]
ȡ������Һ�����ϲ���Һ�������м���һ������H2SO4��Һ����������������������Ȼ��ƣ����������ɫ����������Ϊϡ������Ȼ�����Ӧ�����˰�ɫ�������ᱵ������������ݣ�����Ϊϡ�����̼���Ʒ�Ӧ�����˶�����̼��ʵ�����������ʾ��
ʵ����� | ���� | ���� |
ȡ������Һ�����ϲ���Һ�������м���һ������H2SO4��Һ�� | ���������� | ����I��ȷ |
�а�ɫ�������� | �������ȷ | |
�������� | �������ȷ |
[������˼]
�Ȼ�����̼���Ʒ�Ӧ����̼�ᱵ�������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽ��BaCl2+Na2CO3�TBaCO3��+2NaCl����ַ�Ӧ��̼���ƹ�������Һ�Լ��ԣ�pH����7����ʱ��Һ�д��ڵ�������Na+��Cl-��CO32��
���BaCl2+Na2CO3�TBaCO3��+2NaCl������Na+��Cl-��CO32��

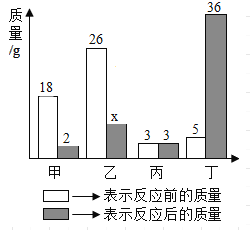
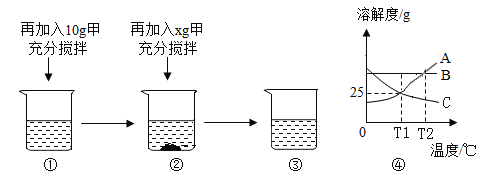
����Ŀ����ͼ��ʾ��Χ������������ö���ӣ���������ϡ���ᡢ����������̼��ơ��������������ʣ��������Ӽ�����߱�ʾ���ʼ���Է�Ӧ����֪����ķ�Ӧ�У��ש���ķ�Ӧ���Ͳ�ͬ������������Ӧ�������췴Ӧ�ܲ���һ�����壬�Ҹ����廹���붡��Ӧ���ɳ����������ж�Ӧ��ϵ��ȷ���ǣ�������
�� | �� | �� | �� | �� | |
A | �� | ������ | ̼��� | �������� | ϡ���� |
B | ������ | �� | ϡ���� | �������� | ̼��� |
C | ������ | �� | ̼��� | �������� | ϡ���� |
D | �� | �������� | ̼��� | ������ | ϡ���� |
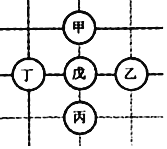
A. A B. B C. C D. D