题目内容
【题目】甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是
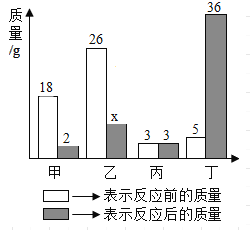
A.丙一定是该反应的催化剂
B.参加反应的甲和乙质量比为16:15
C.丁一定不是单质
D.x的值是11
【答案】A
【解析】
由表中数据分析可知,反应前后甲的质量减少了18g-2g=16g,故是反应物,参加反应的质量为16g;同理可以确定丙的质量不变,可能作该反应的催化剂,也可能没有参加反应;丁是生成物,生成的质量为36g-5g=31g;由质量守恒定律,乙应是反应物,且参加反应的质量为31g-16g=15g,故x的数值为26g-15g=11g。
A、丙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
参加反应的M的质量为25g-20g=5g,故X的数值为18g-5g=13g,故选项说法错误。
B、参加反应的甲和乙质量比为16g:15g=16:15,故选项说法正确。
C、该反应的反应物为甲和乙,生成物是丁,符合“多变一”的形式,属于化合反应,丁是化合反应的生成物,一定不是单质,故选项说法正确。
D、x的数值为26g-15g=11g,故选项说法正确。
故选:A。

【题目】某化学学习小组在完成“利用氯化钡溶液鉴别氯化钠和碳酸钠”的实验后,对废液缸中溶液的溶质成分进行了探究。请完成以下探究。
(提出问题)
废液缸中溶液的溶质是什么?
(作出猜想)
I.仅为氯化钠;
Ⅱ.______;
Ⅲ.氯化钠和碳酸钠;
(设计方案)
实验操作 | 现象 | 结论 |
取少量废液缸中上层清液,向其中加入一定量的____溶液(填化学式,限填一种) | 无明显现象 | 猜想Ⅰ正确 |
有白色沉淀生成 | 猜想Ⅱ正确 | |
________ | 猜想Ⅲ正确 |
(交流反思)
学习小组经过讨论认为,含有可溶性钡盐的废液,若加入过量的碳酸钠溶液处理,请写出氯化钡与碳酸钠反应的化学方程式___________,充分反应后,溶液pH__7(填“>”或“<”或“=”),此时溶液中存在的离子有______。
【题目】金属在生产和生活中具有这的应用
(1)汽车和我们的目常生活密切相关,制造汽车轮胎的橡胶是_________(填“天然高分子材料”成“有机合成材料”)。
(2)信息一:地壳中含量最多的金属元素是__________(填元素符号)。
信息二:铝的化学性质很活泼.但家用铝制品却很少出现腐蚀现象,原因是:________。
信息三:
金属 性质 | 导电性(100为标准) | 密度(g/cm3) |
铜 | 99 | 8.92 |
铁 | 17 | 7.86 |
铝 | 61 | 2.70 |
综合上述因素,常选用表中种金属中的_________作为高压输电线,原因是_________。
(3)初中化学中通过化学反应得到常见金属的方法有两种,一种是湿法冶金,如在氯化铜和氯化锌的混合溶液中加入一定量的铁粉,充分反应后过滤,得到新的金属和滤液,滤液中一定含有的溶质有__________(填化学式):另一种是火法冶金,如将炉甘石(ZnCO3),赤铜(Cu2O)和木炭粉混合后高温加热,得到一种外观似金子的锌和铜的合金。已知炉甘石受热分解的化学方程式是![]() ,请写出生成锌的化学方程式:______________。
,请写出生成锌的化学方程式:______________。