题目内容
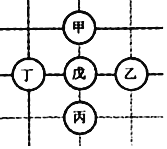
【题目】如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲﹣戊的反应类型不同于其它几个反应;丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
甲 | 乙 | 丙 | 丁 | 戊 | |
A | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
B | 硝酸银 | 铁 | 稀盐酸 | 氢氧化钡 | 碳酸钙 |
C | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
D | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |
A. A B. B C. C D. D
【答案】A
【解析】
丙-戊反应能产生一种气体,且该气体还能与丁反应生成沉淀,铁与盐酸反应产生氢气,盐酸与碳酸钙反应生成二氧化碳,氢气不能与题中其他物质产生沉淀,所以丙-戊反应只能是盐酸与碳酸钙反应,甲-戊的反应类型不同于其它几个反应,只有铁与盐酸反应属于置换反应,其他反应都是复分解反应,所以甲是铁,戊是盐酸,丙是碳酸钙,盐酸与碳酸钙反应生成二氧化碳,二氧化碳能与丁反应生成沉淀,二氧化碳与氢氧化钡反应产生白色沉淀,所以丁是氢氧化钡,乙是硝酸银。故选A。

【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)==Na2SO4+SO2↑+H2O]。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(查阅资料)
(1) Na2SO3有较强还原性,在空气中易被氧气氧化:2 Na2SO3+O2==2Na2SO4;
(2) Na2SO3能与酸反应产生SO2气体;
(3)SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
(作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想2完全变质,成分是Na2SO4;
你认为还可能有的猜想3:_____________________。
(实验探究I)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | _____ | 已部分变质 |
(评价)有同学质疑甲组方案不合理,理由是___________。
(实验探究II)
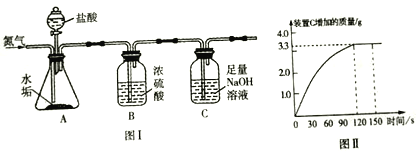
甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
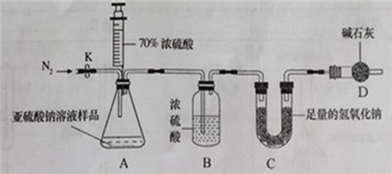
(1)连好装置并检查装置气密性,在锥形瓶中放入126g该样品
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重6.4g。
由此,计算出该溶液中Na2SO3的质量分数为_____________;
(解释)若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的____(填”偏小”或”偏大”)。
乙组仍使用第一次实验的原理,进行如下实验测定Na2SO3溶液的溶质质量分数。
第一步:称取试样ag;
第二步:在溶液中加入过量氯化钡溶液和足量稀盐酸;
第三步:过滤、洗涤、烘干沉淀;
第四步:称量沉淀的质量为bg;
第五步:计算溶液中Na2SO3的溶质质量分数=(1-142b/233a)×100%。
试完成下列问题:
(1)加入氯化钡溶液过量的目的是________________;
(2)第三步操作要洗涤沉淀的原因是______________________;
(反思)由此可得出,保存亚硫酸钠时应___________________________。
【题目】下列选项中相关量的变化与图像不相符的是
选项 | X | Y |
|
A.向一定量饱和食盐水中加水 | 水的质量 | 溶质质量 | |
B.向一定量锌粒中加稀硫酸 | 稀硫酸质量 | 氢气质量 | |
C.向一定量CuCl2溶液中加NaOH溶液 | NaOH溶液质量 | 沉淀质量 | |
D.向一定量水中加KNO3晶体 | KNO3晶体质量 | 溶质质量分数 | |
A. A B. B C. C D. D