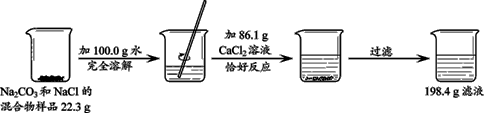题目内容
(5分)为了分析某生铁中铁的含量,学习小组的同学们进行了实验探究,即取6g生铁与10%的盐酸反应,加入盐酸质量与放出气体质量的关系如下表。(说明:生铁中杂质不溶于水,也不与盐酸反应)
(1)上述表格中m的值为 ;
(2)该生铁中铁的质量分数为多少?(写出计算过程,最终结果保留到0.1%)
| 盐酸质量/g | 36.5 | 73 | 109.5 | 146 |
| 气体质量/g | 0.1 | 0.2 | 0.2 | m |
(2)该生铁中铁的质量分数为多少?(写出计算过程,最终结果保留到0.1%)
(5分)
(1)0.2 ················································1分
(2)解:设反应的铁的质量为X
Fe + 2HCl = FeCl2+ H2↑
56 2
X 0.2g ····························1分

X = 5.6g ·········································1分
(也可使用盐酸的质量关系,计算参加反应的铁)
生铁中铁的质量分数= 5.6g/6g×100% = 93.3%···············1分
(3)6克生铁中含有不溶性杂质,不能计算在溶液的质量之内。(说法合理均可)···1分
答:略
(1)0.2 ················································1分
(2)解:设反应的铁的质量为X
Fe + 2HCl = FeCl2+ H2↑
56 2
X 0.2g ····························1分

X = 5.6g ·········································1分
(也可使用盐酸的质量关系,计算参加反应的铁)
生铁中铁的质量分数= 5.6g/6g×100% = 93.3%···············1分
(3)6克生铁中含有不溶性杂质,不能计算在溶液的质量之内。(说法合理均可)···1分
答:略
分析:(1)向一定量的生铁中加入稀盐酸,当生成氢气的量不再增加时说明生铁中的铁已反应完.
(2)根据氢气的质量可求出铁的质量,再根据 ×100%即可求出生铁中铁的质量分数.
×100%即可求出生铁中铁的质量分数.
解:(1)由上述实验数据可发现,当稀盐酸的量加到73g时生铁中的铁已反应完,所以即使加再多的稀盐酸,也不可能产生更多的氢气.故答案为:0.2g
(2)设铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.2g
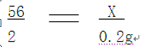
x=5.6g
该生铁中铁的质量分数= 5.6g/6g×100% = 93.3%
答:该生铁中铁的质量分数为93.3%
点评:本道题主要考查的是根据化学方程式的计算,第二小题比较简单,关键是第一小题,解本小题的关键是要会分析实验数据,会从实验数据中找到有用的量
(2)根据氢气的质量可求出铁的质量,再根据
 ×100%即可求出生铁中铁的质量分数.
×100%即可求出生铁中铁的质量分数.解:(1)由上述实验数据可发现,当稀盐酸的量加到73g时生铁中的铁已反应完,所以即使加再多的稀盐酸,也不可能产生更多的氢气.故答案为:0.2g
(2)设铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.2g
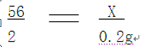
x=5.6g
该生铁中铁的质量分数= 5.6g/6g×100% = 93.3%
答:该生铁中铁的质量分数为93.3%
点评:本道题主要考查的是根据化学方程式的计算,第二小题比较简单,关键是第一小题,解本小题的关键是要会分析实验数据,会从实验数据中找到有用的量

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
 Zn+2Cu+2CO2↑)然后加工成“黄金”饰品出售,非法牟取利益。作为当代中学生,请你利用所学知识揭露“伪黄金”的庐山真面目。
Zn+2Cu+2CO2↑)然后加工成“黄金”饰品出售,非法牟取利益。作为当代中学生,请你利用所学知识揭露“伪黄金”的庐山真面目。 CaCO3↓ + 2NaCl
CaCO3↓ + 2NaCl