题目内容
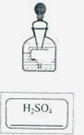
(2011年上海,50题)有一瓶标签破损的稀硫酸,为测定其溶质 ,取出20g溶液,加入足量的锌粒。充分反应后,产生氢气0.02g。
算20g溶液中H2SO4的物质的量(根据化学方程式列式计算)。
②计算并在新标签的横线上填写该溶液的溶质质量分数。
算20g溶液中H2SO4的物质的量(根据化学方程式列式计算)。
②计算并在新标签的横线上填写该溶液的溶质质量分数。
解:①设稀硫酸中溶质的质量为x。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.02g
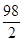 =
=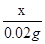 x=0.98g
x=0.98g
②该溶液中溶质的质量分数为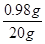 ×100%=4.9%
×100%=4.9%
答:①20g溶液中H2SO4的质量为0.98g。
②如右图。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.02g
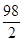 =
=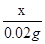 x=0.98g
x=0.98g②该溶液中溶质的质量分数为
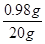 ×100%=4.9%
×100%=4.9%答:①20g溶液中H2SO4的质量为0.98g。
②如右图。

解:①设稀硫酸中溶质的质量为x。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.02g
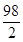 =
=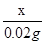 x=0.98g
x=0.98g
②该溶液中溶质的质量分数为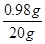 ×100%=4.9%
×100%=4.9%
答:①20g溶液中H2SO4的质量为0.98g。
②如右图。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.02g
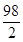 =
=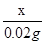 x=0.98g
x=0.98g②该溶液中溶质的质量分数为
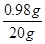 ×100%=4.9%
×100%=4.9%答:①20g溶液中H2SO4的质量为0.98g。
②如右图。


练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目