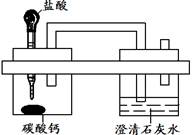
题目内容
(8分)取只含有少量氯化钠杂质的粉末状纯碱样品11.4g于烧杯中,逐滴加入稀盐酸至不再产生气体为止,共消耗稀盐酸的质量为50g,反应后称得烧杯中溶液的质量为57g(假定反应产生的二氧化碳全部逸出,水蒸气挥发忽略不计)。请分析回答下列问题:
(1)题中涉及到的化学反应方程式为 。
(2)运用质量守恒定律,可以算出题中放出二氧化碳的质量为 g。
(3)计算反应后溶液中溶质的质量分数(写出详细的计算过程,数据精确到l%)。
(1)题中涉及到的化学反应方程式为 。
(2)运用质量守恒定律,可以算出题中放出二氧化碳的质量为 g。
(3)计算反应后溶液中溶质的质量分数(写出详细的计算过程,数据精确到l%)。
(1)Na2CO3+2HCl = 2NaCl+H2O+CO2↑
(2)4.4
(3)解:设参加反应的NaCO3的质量为x,反应后生成NaCl的质量为y
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
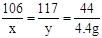 x=10.6g y=11.7g
x=10.6g y=11.7g
故反应后溶液中溶质的质量分数为:
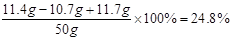
答:反应后溶液中溶质的质量分数为24.8%。
(2)4.4
(3)解:设参加反应的NaCO3的质量为x,反应后生成NaCl的质量为y
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
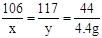 x=10.6g y=11.7g
x=10.6g y=11.7g 故反应后溶液中溶质的质量分数为:
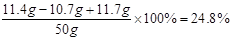
答:反应后溶液中溶质的质量分数为24.8%。
(1)向氯化钠和碳酸钠的混合物中加入稀盐酸,氯化钠和盐酸不反应,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳.故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)11.4g+50g-57g="4.4g" 故答案为:4.4
(3)解:设参加反应的Na2CO3的质量为x,反应后生成NaCl的质量为y
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
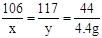 x=10.6g y=11.7g
x=10.6g y=11.7g
故反应后溶液中溶质的质量分数为:
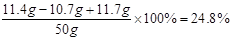
答:反应后溶液中溶质的质量分数为24.8%.
(2)11.4g+50g-57g="4.4g" 故答案为:4.4
(3)解:设参加反应的Na2CO3的质量为x,反应后生成NaCl的质量为y
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
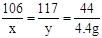 x=10.6g y=11.7g
x=10.6g y=11.7g 故反应后溶液中溶质的质量分数为:
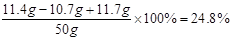
答:反应后溶液中溶质的质量分数为24.8%.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目