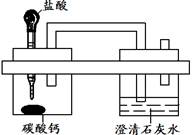
题目内容
(3分)请根据下图所示的实验过程和提供的数据,计算样品中钠元素的质量。 已知:Na2CO3 + CaCl2 CaCO3↓ + 2NaCl
CaCO3↓ + 2NaCl
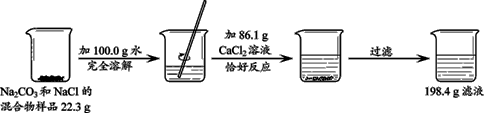
 CaCO3↓ + 2NaCl
CaCO3↓ + 2NaCl

分析:根据图中所给的数据结合质量守恒定律可以求出生成的碳酸钙的质量,然后可以根据沉淀的质量求出碳酸钠的质量,进而求出氯化钠的质量,再结合碳酸钠和氯化钠中钠元素的质量分数可以求出钠元素的质量.
解答:解:根据质量守恒定律结合题给的数据可以知道生成碳酸钙的质量为:22.3g+100.0g+86.1g-198.4g=10.0g,所以可以据此进行求算;
设混合物中碳酸钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.0g
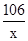 =
= 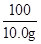
解得:x=10.6g
所以混合物中氯化钠的质量为22.3g-10.6g=11.7g;
所以在混合物中钠元素的质量为:10.6g×(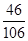 ×100%)+11.7g×(
×100%)+11.7g×(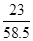 ×100%)=4.6g+4.6g=9.2g;
×100%)=4.6g+4.6g=9.2g;
答:样品中钠元素的质量为9.2g.
故答案为:9.2g.
点评:本题中考查的知识点较多,主要是依据化学方程式进行计算,在解答时要注意运用质量守恒定律来得出计算所必须的已知量,然后依据化学方程式进行计算,同时要学会求算物质中元素的质量.
解答:解:根据质量守恒定律结合题给的数据可以知道生成碳酸钙的质量为:22.3g+100.0g+86.1g-198.4g=10.0g,所以可以据此进行求算;
设混合物中碳酸钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.0g
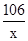 =
= 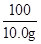
解得:x=10.6g
所以混合物中氯化钠的质量为22.3g-10.6g=11.7g;
所以在混合物中钠元素的质量为:10.6g×(
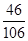 ×100%)+11.7g×(
×100%)+11.7g×(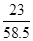 ×100%)=4.6g+4.6g=9.2g;
×100%)=4.6g+4.6g=9.2g;答:样品中钠元素的质量为9.2g.
故答案为:9.2g.
点评:本题中考查的知识点较多,主要是依据化学方程式进行计算,在解答时要注意运用质量守恒定律来得出计算所必须的已知量,然后依据化学方程式进行计算,同时要学会求算物质中元素的质量.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目