题目内容
2.8克CO在高温下,跟5.8克铁的某种氧化物恰好完全反应,该氧化物是( )
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.FeS2 |
C
考点:
专题:化学式推断十字法;有关化学方程式的计算.
分析:根据CO与金属氧化物的反应特点:每个CO分子夺取一个O原子而变成一个二氧化碳分子,可由消耗CO的质量计算出氧化物中氧元素的质量;然后根据氧化物中铁、氧元素质量比,求出氧化物中原子个数比及化学式.
解答:解:反应中消耗CO质量与氧化物中氧元素质量关系为28:16;
则2.8克CO在高温下跟5.8克铁的某种氧化物完全反应时,5.8克铁的某种氧化物中氧元素质量=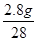 ×16=1.6g;
×16=1.6g;
5.8克铁的某种氧化物中铁元素质量=5.8g-1.6g=4.2g
铁的某种氧化物中铁元素与氧元素的原子个数比=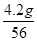 :
: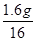 =3:4;
=3:4;
则铁的某种氧化物的化学式可表示为Fe3O4;
故选C.
点评:由CO还原铁的氧化物的反应规律,确定出反应中CO与O元素的质量关系是解答本问题的技巧所在,确定了二者的质量关系即可计算出氧化物中组成元素质量关系.
专题:化学式推断十字法;有关化学方程式的计算.
分析:根据CO与金属氧化物的反应特点:每个CO分子夺取一个O原子而变成一个二氧化碳分子,可由消耗CO的质量计算出氧化物中氧元素的质量;然后根据氧化物中铁、氧元素质量比,求出氧化物中原子个数比及化学式.
解答:解:反应中消耗CO质量与氧化物中氧元素质量关系为28:16;
则2.8克CO在高温下跟5.8克铁的某种氧化物完全反应时,5.8克铁的某种氧化物中氧元素质量=
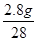 ×16=1.6g;
×16=1.6g;5.8克铁的某种氧化物中铁元素质量=5.8g-1.6g=4.2g
铁的某种氧化物中铁元素与氧元素的原子个数比=
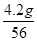 :
: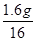 =3:4;
=3:4;则铁的某种氧化物的化学式可表示为Fe3O4;
故选C.
点评:由CO还原铁的氧化物的反应规律,确定出反应中CO与O元素的质量关系是解答本问题的技巧所在,确定了二者的质量关系即可计算出氧化物中组成元素质量关系.

练习册系列答案
相关题目