题目内容
漂白粉的主要成分是CaCl2和Ca(ClO)2。工业上制取漂白粉的反应可表示为:2Cl2 + 2Ca(OH)2 CaCl2 + Ca(ClO)2 + 2H2O;欲制取含50.8 kg CaCl2和Ca(ClO)2的漂白需要氯气的质量至少为多少?
28.4g
【解】设:漂白粉中CaCl2的质量为x,则Ca(ClO)2的质量为50.8 kg﹣x。
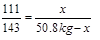
x =" 22.2" kg
设:需要氯气的质量至少为y。
2Cl2 + 2Ca(OH)2 CaCl2 + Ca(ClO)2 + 2H2O
142 111
y 22.2 kg
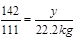
y =" 28.4" kg
答:需要氯气的质量至少为28.4 kg。
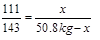
x =" 22.2" kg
设:需要氯气的质量至少为y。
2Cl2 + 2Ca(OH)2 CaCl2 + Ca(ClO)2 + 2H2O
142 111
y 22.2 kg
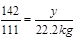
y =" 28.4" kg
答:需要氯气的质量至少为28.4 kg。

练习册系列答案
相关题目