题目内容
【题目】黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量进行了如下的实验探究(假设每步反应均完全)。
【查阅资料】 ①4FeS2+11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
Ⅰ. 称取2.40 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
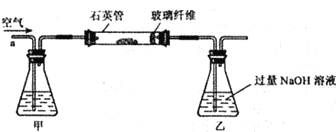
Ⅱ. 反应结束后,将乙瓶中的溶液进行如下处理:
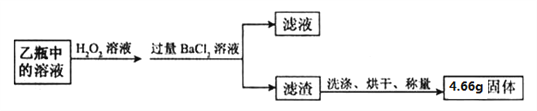
【问题讨论】
(1)Ⅰ装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是______________。
(2)Ⅰ装置中乙瓶内发生反应的化学反应方程式是____________________。
【含量测定】
(3)计算该黄铁矿中FeS2的质量分数__________________。(请写出计算过程)
【交流反思】
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会________________(填“偏大”“偏小”或“不变”)。
(5)Ⅱ中检验滤渣是否洗涤干净的方法是,取最后一次洗涤液,加入_____________,说明已洗涤干净。
【拓展应用】
工业上以黄铁矿为原料生产硫酸的工艺流程图如下所示:
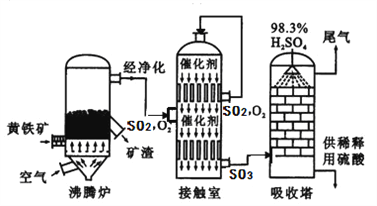
(6)接触室中发生反应的化学方程式为________________________。化学实验室常需要用到较稀的硫酸,把浓硫酸稀释的操作是_______________________________________,硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途______________________。
(7)依据生产硫酸的工艺流程图,下列说法正确的是_______________(填字母)。
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.沸腾炉排出的矿渣可供炼铁 D.吸收塔中为了提高吸收效率,采用喷淋的方式
【答案】 吸收空气中的二氧化碳 方程式略 硫元素的质量:4.66g*32/233=0.64g FeS2的质量:0.64g/64/120=1.2g 1.2g/2.4g*100%=50% 偏大 滴加硫酸钠溶液,若无白色沉淀,则已洗净。(合理即可) 2SO2+O2=2SO3 酸入水,边加边搅拌(合理即可) ACD
【解析】(1)由于空气中的二氧化碳能与氢氧化钠反应,会对实验造成干扰,故要将空气中的二氧化碳除去;氢氧化钠与二氧化硫反应生成亚硫酸钠和水,反应的化学方程式表示为:2NaOH+SO2===Na2SO3+H2O;(3)最终所得的沉淀是硫酸钡沉淀,根据硫原子守恒可得硫元素的质量。设硫元素的质量为x;
S——--BaSO4
32 233
X 4.66g
![]() x=0.64g
x=0.64g
FeS2的质量=![]() 1.2g
1.2g
该黄铁矿中FeS2的质量分数=![]() 50% ;
50% ;
(4)如果缺少甲装置,那么亚硫酸钠的质量偏大,沉淀的质量也偏大,最终导致测得FeS2的质量分数偏大;(5)Ⅱ中检验滤渣是否洗涤干净,即证明滤渣上是否含有氯化钡,那么可滴加硫酸钠溶液,若无白色沉淀,则已洗净;(6)由工业流程图可知,接触室中,在催化剂的催化作用下,二氧化硫和氧气反应生成了三氧化硫,反应的化学方程式表示为:2SO2+O2![]() 2SO3 ;稀释浓硫酸的方法是:将浓硫酸沿容器的内壁慢慢的注入水中并不断的搅拌;稀硫酸是主要的化工原料,可用于生产化肥、农药、火药,还可用于除铁锈等;(7)A、将黄铁矿粉碎可增大与氧气的接触面积,使其充分燃烧,正确;B、催化剂只能改变反应速率,不能改变生成物的量,错误;C、沸腾炉排出的矿渣含有铁元素,可用于炼铁,正确;D、采用喷淋的方式可使它们充分接触,提高吸收效率,正确。故选ACD。
2SO3 ;稀释浓硫酸的方法是:将浓硫酸沿容器的内壁慢慢的注入水中并不断的搅拌;稀硫酸是主要的化工原料,可用于生产化肥、农药、火药,还可用于除铁锈等;(7)A、将黄铁矿粉碎可增大与氧气的接触面积,使其充分燃烧,正确;B、催化剂只能改变反应速率,不能改变生成物的量,错误;C、沸腾炉排出的矿渣含有铁元素,可用于炼铁,正确;D、采用喷淋的方式可使它们充分接触,提高吸收效率,正确。故选ACD。