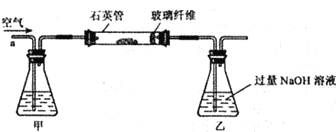
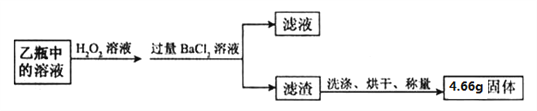
题目内容
【题目】回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下。
已知:CuO + H2SO4 = Cu SO4 + HO ; Fe + Fe2(SO4)3 = 3Fe SO4
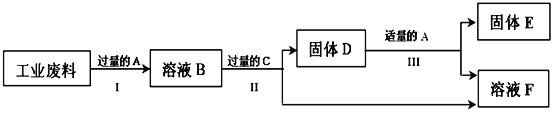
(1)写出过程Ⅲ的化学方程式是________。
(2)A~F中,含铁元素的有(填字母序号): _____________。
【答案】 Fe + H2SO4== FeSO4+ H2↑ BCDF
【解析】为了将硫酸铜中的铜全部置换出来,需要加入过量的铁,要得到纯铜,需要加入硫酸将过量的铁除去;铁与硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(4)根据分析推断,A中含有硫酸,B中含有硫酸、硫酸铜和硫酸铁,C是铁,D中含有铁和铜的混合物,E是铜,F中含有硫酸亚铁,故填:BCDF。

【题目】化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关;②可能与锌的形状有关。
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟)。

(1)锌与硫酸反应的化学方程式为_______________________________。
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:
氢气→______________________(填导管口序号)。
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是______。
【得出结论】依据上表得出的结论是____________________________________。
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积)。
时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
请解释锌与稀硫酸反应由快变慢的原因____________________________________。
(5)锌与硫酸反应的快慢可能还会受_____________因素影响,如果用实验验证该因素对反应快慢的影响,应该控制________________因素不同,而其他因素则相同。