题目内容
【题目】某化学兴趣小组同学制作了一副化学扑克牌,每张牌中含有一种物质。下图是其中的9张牌,请根据9张牌完成下列问题。
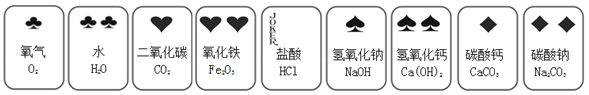
(1)9种物质中属于单质的是_______。
(2)进行游戏。
游戏规则:依据问题,进行抢答。
①若两张牌上的物质反应后溶液变为黄色,则该反应的化学方程式是________。
②上述9张牌中除水外的另外8种物质都能转化生成水,写出化合反应转化生成水的化学方程式是________。
(3)“九宫格”起源于河图洛书,是中国古代流传下来的神秘图案。将9张牌排列成如下“九宫格”,其相邻的任何两种物质间均能发生反应或转化,若“九宫格”中的2、4、6和8四张牌分别代表Na2CO3 、CO2 、Ca(OH)2 、Fe2O3,则1、3、5、7、9五张牌分别代表_______________。

【答案】 O2 Fe2O3+6HCl=2FeCl3+3H2O 2H2+ O2![]() 2H2O HCl、O2 、H2O、 CaCO3、 NaOH或HCl、O2 、H2O、NaOH、 CaCO3
2H2O HCl、O2 、H2O、 CaCO3、 NaOH或HCl、O2 、H2O、NaOH、 CaCO3
【解析】(1)单质是由一种元素组成的纯净物。属于单质的是氧气;
(2)①氧化铁与盐酸反应生成氯化铁和水,氯化铁溶液显黄色,化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
②氢气在氧气中燃烧生成水,化学方程式为:2H2+ O2![]() 2H2O;
2H2O;
(3)若“九宫格”中的2、4、6和8四张牌分别代表Na2CO3 、CO2 、Ca(OH)2 、Fe2O3,9可以同时与Na2CO3 、CO2反应,九种物质中没有同时与Na2CO3 、CO2反应的,但是Na2CO3 、CO2都可转化为CaCO3,所以9为CaCO3(CO2可以与NaOH反应,Na2CO3可以转化为NaOH,9也可以为NaOH);Na2CO3 、Ca(OH)2 可以转化为NaOH,7为:NaOH(Na2CO3 、Ca(OH)2 可以转化为CaCO3,7也可以为:NaOH);Ca(OH)2 、Fe2O3都可以与盐酸反应,所以1为盐酸;氧气可以转化为CO2 、Fe2O3,所以3为O2;5为H2O。

【题目】某校化学兴趣小组参观制碱厂后,获得以下信息井对相关问题进行研究。
【查阅资料】
①无水硫酸铜是白色固体,吸水变蓝。
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaC12)及不溶性杂质。
③生产原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4C1。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是NH4Cl===NH3↑+HCl↑。
⑤部分生产流程如下图所示:

【问题讨论】
(1)①溶液A中的溶质有NaCl和__________、______________。
②操作Ⅱ的名称为___________。
③写出加入NaOH溶液所发生反应的化学方程式___________。
④流程中Na2CO3溶液的作用是除去粗盐中的___________。
(2)上述生产流程中可循环使用的是___________ (填序号)。
A.NH3 B. NaOH C. HCl D .CO2
【组成探究】
(3)①晶体A受热分解的化学方程式为 ________________________。
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下列装置中选择):

选择的装置 | 实验现象 | 实验结论 |
________ | ________ | 样品不含晶体A |
【组成探究二】
(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。产生沉淀的方程式为_______________,由此确定纯碱样品含有杂质NaCl。
【组成探究三】
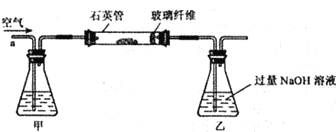
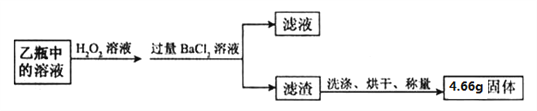
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①氯化钡溶液过量的目的是___________________。
②判断滤渣是否洗干净,可向最后的洗出液中滴加________,然后观察现象判断。
A.氯化钡溶液 B.稀硫酸 C.稀盐酸 D.碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为__________。(精确到0. 1 % )