题目内容
【题目】炎热的夏天,在家中可以自制汽水来解暑。
【制备材料】1.5g小苏打、1.5g柠檬酸、蔗糖、果汁、凉开水、500ml饮料瓶
【制作过程】如下图所示。

(1)柠檬酸易溶于水,其水溶液显酸性。检验柠檬酸的水溶液显酸性,可以选择下列物质中的______(填字母序号)。
A. 铁钉 B.铜丝 C.鸡蛋壳 D.食盐
(2)上述自制汽水属于“碳酸饮料”,其中碳酸的来源是________。
(3)材料中的小苏打是______的俗称,其水溶液显碱性。
(4)打开该汽水瓶盖,能够看到的现象是_______,发生反应的化学方程式是________。
【答案】 AC 柠檬酸与小苏打反应生成碳酸 碳酸氢钠 有大量气泡冒出 H2CO3 = H2O + CO2↑
【解析】(1)A、铁钉可以与酸反应生成氢气,有气泡冒出,所以可以检验柠檬酸的水溶液显酸性;
B、铜丝不能与酸反应,所以不可以检验柠檬酸的水溶液显酸性;
C、鸡蛋壳的主要成分是碳酸钙,碳酸钙与酸反应生成二氧化碳,有气泡冒出,所以可以检验柠檬酸的水溶液显酸性;
D、食盐与酸不反应,所以不可以检验柠檬酸的水溶液显酸性;
(2)小苏打是碳酸氢钠的俗名,碳酸氢钠可以与柠檬酸反应生成碳酸;
(3)小苏打是碳酸氢钠的俗名;
(4)打开该汽水瓶盖,瓶中压强会减小,二氧化碳的溶解度随之减小,有大量气泡冒出,部分的碳酸分解为水和二氧化碳,化学方程式为:H2CO3 = H2O + CO2↑。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案【题目】某校化学兴趣小组参观制碱厂后,获得以下信息井对相关问题进行研究。
【查阅资料】
①无水硫酸铜是白色固体,吸水变蓝。
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaC12)及不溶性杂质。
③生产原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4C1。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是NH4Cl===NH3↑+HCl↑。
⑤部分生产流程如下图所示:

【问题讨论】
(1)①溶液A中的溶质有NaCl和__________、______________。
②操作Ⅱ的名称为___________。
③写出加入NaOH溶液所发生反应的化学方程式___________。
④流程中Na2CO3溶液的作用是除去粗盐中的___________。
(2)上述生产流程中可循环使用的是___________ (填序号)。
A.NH3 B. NaOH C. HCl D .CO2
【组成探究】
(3)①晶体A受热分解的化学方程式为 ________________________。
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下列装置中选择):

选择的装置 | 实验现象 | 实验结论 |
________ | ________ | 样品不含晶体A |
【组成探究二】
(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。产生沉淀的方程式为_______________,由此确定纯碱样品含有杂质NaCl。
【组成探究三】
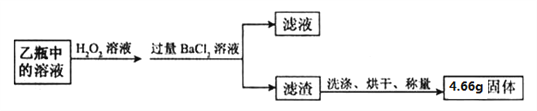
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①氯化钡溶液过量的目的是___________________。
②判断滤渣是否洗干净,可向最后的洗出液中滴加________,然后观察现象判断。
A.氯化钡溶液 B.稀硫酸 C.稀盐酸 D.碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为__________。(精确到0. 1 % )
【题目】漂白粉的主要成分为次氯酸钙 [Ca(ClO)2] 和氯化钙,即可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是 [Ca(ClO)2] ,漂白的原理是:Ca(ClO)2在空气中发生反应。Ca(ClO)2+ CO2+ H2O=CaCO3↓+ 2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)HClO在常温下分解,反应为2HClO=2HCl+ O2↑。某瓶HClO溶液放置一段时间后,溶液的pH________ (填“增大”或“减小”或“不变”)。
(2)在漂白粉中滴加盐酸,能加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式______________。
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验。
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为_______________________;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3。
【实验探究】限选试剂及仪器,盐酸、石灰水、品红溶液、试管、带导管的单孔塞。
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中, ____________________________。 | 有气体产生,气体使石灰水变浑浊。 | 猜想2成立 |
②在上述反应后试管中加少量 _____________。 | _________________________。 |
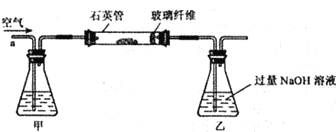
(4)现有实验后的HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案:

【实验数据】上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应后,共记录了两组实验数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
(1)m=______.
(2)上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为多少?.(不考虑过滤中的损失,计算结果保留到小数点后一位.)__________。