题目内容
某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?
7.35g
解析试题分析:解:40g氢氧化钠溶液中所含氢氧化钠的质量为:40g×15%=6g
设一定量的石油产品中含H2SO4的质量为x
2NaOH+H2SO4=Na2SO4+2H2O
40×2 98
6g x
80/98=6g/x
x=7.35g
答:一定量的石油产品中含H2SO47.35g
考点:根据化学方程式的计算

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
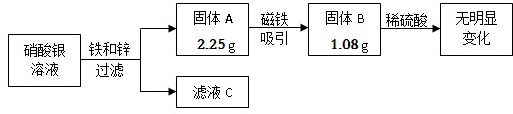
某同学为测定某大理石中碳酸钙(假设:大理石中的杂质不与盐酸反应)的质量分数,取四份样品分别加稀盐酸反应,其实验数据记录如下:
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 10.0 | 10.0 | 10.0 | 10.0 |
| 取稀盐酸质量(g) | 25.0 | 50.0 | 75.0 | 100.0 |
| 产生气体质量(g) | 1.1 | X | 3.3 | 3.3 |
请计算:
(1)经过分析,在第1次测得的数据中, (填物质)完全反应了;
(2)表格中X= g;
(3)该大理石样品中碳酸钙的质量分数是多少?
(4)画出在10.0g样品中加稀盐酸的质量与产生气体质量变化关系的示意图;
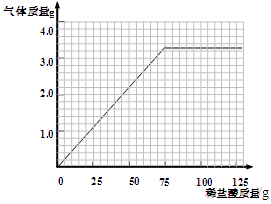
⑴一定条件下,下列物质在密闭容器内充分反应,反应前后各物质的质量如下:
| 物质 | A | B | C | D |
| 反应前的质量/g | 1.7 | 2.2 | 7.9 | 0.9 |
| 反应后的质量/g | 待测 | 6.6 | 0 | 2.7 |
③反应中B和D两种物质变化的质量比为 (最简整数比)。
⑵人体缺少钙元素会影响健康,因此每日需摄人足够的钙。目前市场上的补钙药剂很多,以下是某品牌补钙药剂说明书的部分信息。请仔细阅读后进行计算:

①(1分)葡萄糖酸钙的相对分子质量为____________。
②(1分) 葡萄糖酸钙中碳、氢、氧、钙四种元素的质量比为 。
③(1分) 葡萄糖酸钙中钙元素的质量分数为多少?(保留至0.1%,写计算过程,下同)
④(1分)按照说明书的用量,每天可补充多少mg钙元素?(精确到0.1)
一瓶久置的氢氧化钠固体已经发生了变质,某研究小组为了探究氢氧化钠的变质纯度,作出如下猜想:猜想一、可能部分变质,固体是NaOH和Na2CO3的混合物;猜想二、可能全部变质,固体是Na2CO3。
(1)首先对固体的成分进行确定。取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层溶液,再加入CuSO4溶液,产生蓝色絮状沉淀。根据实验现象,可判断 是正确的。
(2)称取10.6克该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
计算该样品中Na2CO3的质量分数。
(3)请你分析,一定质量的NaOH固体,变质前后与足量的稀盐酸反应,变质前生成NaCl
的量 (填“大于”、“等于”、或“小于”)变质后生成NaCl的量。