题目内容
某同学为测定某大理石中碳酸钙(假设:大理石中的杂质不与盐酸反应)的质量分数,取四份样品分别加稀盐酸反应,其实验数据记录如下:
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 10.0 | 10.0 | 10.0 | 10.0 |
| 取稀盐酸质量(g) | 25.0 | 50.0 | 75.0 | 100.0 |
| 产生气体质量(g) | 1.1 | X | 3.3 | 3.3 |
请计算:
(1)经过分析,在第1次测得的数据中, (填物质)完全反应了;
(2)表格中X= g;
(3)该大理石样品中碳酸钙的质量分数是多少?
(4)画出在10.0g样品中加稀盐酸的质量与产生气体质量变化关系的示意图;

(1)稀盐酸、(2)2.2g (3)75%
解析试题分析:(1)第1份和第2份比较可以发现,当稀盐酸的质量增加时,气体的质量也在增加,说明第1份中碳酸钙没有完全反应,稀盐酸完全反应.(2)第1份放出二氧化碳的质量为1.1g,说明每加入稀盐酸25.0g与碳酸钙完全反应,产生二氧化碳的质量为1.1g;第3份加入盐酸75.0g,是第1份稀盐酸质量的3倍,产生二氧化碳的质量为3.3g,也是第1份产生气体质量的3倍;而第2份加入盐酸,是第1份稀盐酸质量的2倍,故产生二氧化碳的质量为2.2g;(3)第4份与第3份产生的二氧化碳质量相等,说明第3份时碳酸钙已经完全反应。
解:设参加反应的碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g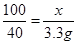
x = 7.5g
大理石中碳酸钙的质量分数= ×100%=75%
×100%=75%
答:石灰石中碳酸钙的质量分数为75%
(4)找出起点0,最大值3.3,折点3.3,曲线的走势,画出图象即可.
考点:实验数据处理或者误差分析的探究;根据化学反应方程式的计算;酸的化学性质;碳酸钠、碳酸氢钠与碳酸钙.

练习册系列答案
相关题目
为测定黄铜(锌铜合金)样品的组成,某同学取四个样品分别加稀硫酸做了四次实验,其实验数据记录如下表..
| 实验次数 | l | 2 | 3 | 4 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)反应的化学方程式
(2)列出计算黄铜中参加反应的金属质量(X)的比例式:
(3)参加反应的稀硫酸的溶质质量分数
(4)向第一次实验所得溶液中加入47.4g水,溶液中溶质的质量分数
(5)若工业上用125t含Cu2S 70%的辉铜矿炼制该黄铜,理论上能炼制出黄铜的质量为 。