题目内容
某同学将15.0g碳酸钙粉末置于250mL、87.0g的烧杯中,向其中加入105.4g某浓度的稀盐酸,充分反应后,称得烧杯及其剩余物的总质量为203.0g。则:
(1)反应生成的二氧化碳的质量为________________g;(1分)
(2)烧杯内各物质的名称分别为_________ __________;(2分)
(3)列式计算所得溶液的溶质质量分数。(3分)
(1)4.4g (2)碳酸钙、氯化钙、水 (3)10%
解析试题分析:
(1)该反应中只有二氧化碳是气体,则二氧化碳的质量为15.0g+87.0g+105.4g-203.0g=4.4g,故答案为:4.4g;
(2)烧杯中肯定有氯化钙、水这两种生成物,但由于题中没有明确指出“恰好完全反应”,所以还应考虑反应物有剩余的可能性。为此,我们通过生成4.4g二氧化碳,代入化学方程式可求得参加反应的碳酸钙的质量,从而判断碳酸钙是否有剩余。过程如下:
设参加反应的碳酸钙的质量为X
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 4.4g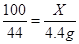
X=10.0g
即碳酸钙有剩余,所以,烧杯中的物质有碳酸钙、氯化钙、水三种物质。
(3)所得溶液为氯化钙溶液,其质量分数为 ,为此需先求得氯化钙溶质及氯化钙溶液的质量各是多少,再代入即得结果。过程如下:
,为此需先求得氯化钙溶质及氯化钙溶液的质量各是多少,再代入即得结果。过程如下:
设生成的氯化钙的质量为Y
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 44
Y 4.4g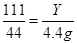
Y=11.1g
反应后溶液质量为10g+105.4g-4.4g=111g
所得溶液的溶质质量分数为: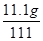 ×100%=10%
×100%=10%
考点:化学综合计算

化学兴趣小组为了测定石灰石中碳酸钙的质量分数(杂质不溶于水,也不与盐酸反应).测得的数据如下:
| 实验组次 | 1 | 2 | 3 | 4 |
| 样品质量/g | 30 | 20 | 20 | 30 |
| 稀盐酸的质量/g | 50 | 50 | 100 | 100 |
| 产生气体的质量/g | 6.6 | 6.6 | 6.6 | m |
(1)m的值为多少?
(2)第 组实验恰好完全反应?
(3)该石灰石样品的纯度是多少?
实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式: _____________________
小倩发现,氯酸钾与氧化铁混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铁外,氧化铜也可以作氯酸钾分解的催化剂.
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好).
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | 氯酸钾 | 580 |
| ② | 氯酸钾、二氧化锰(质量比1:1) | 350 |
| ③ | 氯酸钾、氧化铁(质量比l:1) | 390 |
| ④ | 氯酸钾、氧化铜(质量比1:1) | 370 |
【分析数据、得出结论】
(1)由实验 与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是________.
【反思】
(1)若要证明氧化铜是该反应的催化剂,还要验证它在化学反应前后质量和____不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证___________________________________________________;
 12CO2↑+ 10H2O↑+ 6X↑+ O2↑
12CO2↑+ 10H2O↑+ 6X↑+ O2↑