题目内容
实验室有瓶存放一段时间的氢氧化钠固体,部分已变质为碳酸钠.取2.00g该固体,先加水充分溶解,再加入足量澄清石灰水,生成1.00g碳酸钙沉淀.计算:
(1)2.00g该固体中碳酸钠的质量;
(2)该氢氧化钠固体的变质程度.(计算结果保留到1%)
(提示:氢氧化钠的变质程度是指已变质的氢氧化钠占变质前氢氧化钠的质量分数)
(1)2.00g该固体中碳酸钠的质量为1.06g;(2)该氢氧化钠固体的变质程度为46%.
解析试题分析:(1)设碳酸钠的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 1.00g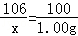
x=1.06g
(2)设变质的氢氧化钠的质量为y.
2NaOH+CO2=Na2CO3+H2O
80 106
y 1.06g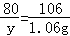
y=0.8g
该氢氧化钠固体的变质程度=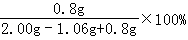 =46%
=46%
答:(1)2.00g该固体中碳酸钠的质量为1.06g;(2)该氢氧化钠固体的变质程度为46%.
考点:根据化学反应方程式的计算.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下图为某浓盐酸的商标。计算回答下列问题:
(1)某研究小组的同学欲用该盐酸配制50mL7.3%的稀盐酸(此稀盐酸的密度取1.0g/mL),需要该浓盐酸_______g。(计算结果保留整数)
(2)用上述所配制稀盐酸测定氢氧化钠的含量。具体操作是:在被测的一定量的氢氧化钠溶液中逐滴加入上述所配制的稀盐酸,并测量不同时间溶液的pH,记录数据如下表:
| 反应时间(秒) | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
| 滴入稀盐酸体积(mL) | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
| pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
①观察上表发现,当反应时间在_________秒时,氢氧化钠与盐酸恰好完全中和;
②结合上表中滴入盐酸体积与pH的变化数据,试计算被测氢氧化钠溶液中溶质的质量。(计算结果精确至0.1g)
化学兴趣小组为了测定石灰石中碳酸钙的质量分数(杂质不溶于水,也不与盐酸反应).测得的数据如下:
| 实验组次 | 1 | 2 | 3 | 4 |
| 样品质量/g | 30 | 20 | 20 | 30 |
| 稀盐酸的质量/g | 50 | 50 | 100 | 100 |
| 产生气体的质量/g | 6.6 | 6.6 | 6.6 | m |
(1)m的值为多少?
(2)第 组实验恰好完全反应?
(3)该石灰石样品的纯度是多少?
 2CuSO4 + 2H2O)现有溶质的质量分数为10%的稀硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不和其他杂质反应,求反应后硫酸铜溶液中溶质的质量分数。(最后结果精确到0.1%)
2CuSO4 + 2H2O)现有溶质的质量分数为10%的稀硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不和其他杂质反应,求反应后硫酸铜溶液中溶质的质量分数。(最后结果精确到0.1%)