题目内容
将氯化钙和碳酸钙的混合物12g放入一个烧杯中,然后往其中加入123.4g稀盐酸,恰好完全反应,称量反应后剩余物质的总质量为131g.计算:
(1)生成二氧化碳的质量是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
(1)4.4g (2)10%
解析试题分析:(1)根据质量守恒定律,生成二氧化碳的质量=12g+123.4g﹣131g=4.4g;
(2)设原混合物中含有碳酸钙的质量为x,生成氯化钙的质量为y,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 4.4g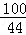 =
=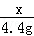 ,解得x=10g;
,解得x=10g;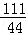 =
=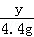 ,解得y=11.1g;
,解得y=11.1g;
反应后所得溶液中溶质的质量分数是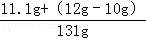 ×100%=10%.
×100%=10%.
答:(1)生成二氧化碳的质量是4.4g;
(2)反应后所得溶液中溶质的质量分数是10%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题难度较大,主要考查了以化学方程式计算为基础,同时融入溶液等方面的计算题,这样的题目一直是中考的热点,主要培养学生的综合分析能力和计算能力.

如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
(1)为测定室温下Na2CO3的溶解度,在编号为A、B、C、D的四个烧杯中各加入室温下的水100g,并分别加入取自实验室的Na2CO3固体,搅拌至充分溶解,实验数据记录如表:
| 烧杯编号 | A | B | C | D |
| 水的质量/克 | 100 | 100 | 100 | 100 |
| 加入Na2CO3的质量/克 | 30 | 35 | 40 | 50 |
| 溶液的质量/克 | 130 | 135 | 140 | 140 |
(2)为确定食用纯碱的纯度,称取自带的食用纯碱5.4g放入烧杯中,再滴加盐酸至刚好完全反应,共用去稀盐酸25g,得溶质质量为28.2g(杂质溶于水且与盐酸不反应),通过计算判断该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符.(计算结果精确到0.1%)
化肥对提高农作物的产量具有重要的作用,碳铵(碳酸氢铵)就是农民朋友经常使用的一种氮肥,碳铵易溶于水、受潮时常温分解,温度越高分解越快,遇碱时放出氨气。某校化学兴趣小组为测定某碳铵肥料样品的纯度,将8.5g样品加入足量的浓氢氧化钠溶液中共热,(碳铵中的杂质不与氢氧化钠反应,反应的方程式为NH4HCO3+2NaOH = Na2CO3+2H2O+NH3↑),把产生的所有NH3用足量的硫酸溶液吸收,同时测量两分钟内硫酸溶液增加的质量,结果如下表所示。
| 时间/S | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
试回答下列问题:
(1)根据碳酸氢铵的性质,你认为在使用碳铵肥料时应注意的问题是___________________。
(2)请在坐标纸上,以反应时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为_________________。
(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果保留一位小数)。
