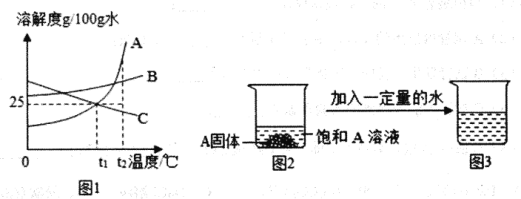
题目内容
【题目】实验室有一瓶在空气中露置的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行了探究。
(提出问题1)该样品中含有哪些物质?
(提出猜想)通过分析,提出如下猜想:
猜想Ⅰ:该样品中只含Na2CO3;
猜想Ⅱ:该样品中含有NaOH和Na2CO3;
猜想Ⅲ:__________________。
则NaOH变质原因的化学方程式为__________________。
(查阅资料)
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和的碳酸氢钠溶液中几乎不溶解。
(实验探究1)
为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入足量 CaCl2溶液 | ______________ | 证明猜想Ⅲ不成立;该反应的化学方程式为__________ |
(2)将上述反应后的混合液过滤,取滤液加入____________; | 溶液变红 | 证明猜想Ⅱ成立 |
(实验反思)
要除去NaOH中的Na2CO3应选择的化学试剂是_____________。
(提出问题2)如何测量该部分变质样品中碳酸钠的质量分数?
(实验探究2)
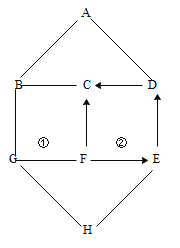
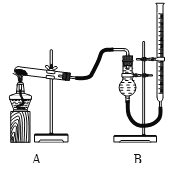
小红同学设计如图所示的装置(铁架台略去),实验在27℃,101kPa 下进行,步骤如下:
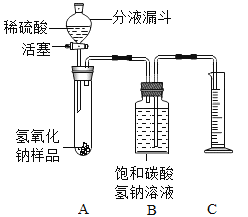
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和的碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和的碳酸氢钠溶液244mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是_______________;
(2)B中集气瓶盛装的饱和的碳酸氢钠溶液不能用水代替,其理由是_______________;
(3)试管中原有的空气对实验结果是否有明显影响?______________(填“有”或“没有”)。
(4)变质氢氧化钠样品中碳酸钠的质量分数为________________。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【答案】该样品中只含NaOH ![]() 有白色沉淀产生 CaCl2+Na2CO3=CaCO3↓+2NaCl 酚酞 氢氧化钙或氢氧化钡 检查装置气密性 二氧化碳能溶于水且要与水发生化学反应 没有 49%
有白色沉淀产生 CaCl2+Na2CO3=CaCO3↓+2NaCl 酚酞 氢氧化钙或氢氧化钡 检查装置气密性 二氧化碳能溶于水且要与水发生化学反应 没有 49%
【解析】
提出猜想:
氢氧化钠会与空气中的二氧化碳反应生成碳酸钠和水,根据氢氧化钠变质的情况,如果氢氧化钠没有变质,则该样品中只含NaOH,氢氧化钠变质是与二氧化碳反应生成碳酸钠和水;反应方程式为:![]() ;
;
实验探究1:
猜想Ⅲ不成立,则固体中存在碳酸钠,氯化钙溶液和碳酸钠反应生成白色沉淀碳酸钙和氯化钠,所以观察到产生了白色沉淀,则说明在该固体中含有碳酸钠,该反应的化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
碳酸钠被完全反应后,若溶液能够使酚酞溶液变红,则说明溶液呈碱性,从而可以判断该溶液中含有氢氧化钠。若酚酞试液没有变红,说明不含有氢氧化钠,则猜想Ⅰ成立;若酚酞试液变红,说明不含有氢氧化钠,则猜想Ⅱ成立;
实验反思:Na2CO3能与氢氧化钙(或氢氧化钡)反应生成碳酸钙(或碳酸钡)沉淀和氢氧化钠溶液,能除去杂质且没有引入新的杂质;要除去NaOH中的Na2CO3应选择的化学试剂是氢氧化钙或氢氧化钡;
实验探究2:
(1)做有气体参与的连续性实验的一般步骤是,连接装置→检验装置气密性→装药品→做实验。在实验步骤①和②之间,还缺少实验步骤,该实验步骤是检验装置气密性;
(2)本题的实验是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水且与水发生化学反应,所以用饱和的碳酸氢钠水溶液,可以避免二氧化碳的减少;B中集气瓶盛装的饱和的碳酸氢钠溶液不能用水代替,其理由是二氧化碳能溶于水且与水发生化学反应;
(3)空气中含有的二氧化碳量很少,试管中原有的空气对实验结果没有明显影响;
(4)224mL=0.224L,则生成二氧化碳的质量=0.224L×1.8 g/L=0.4032g;
设:样品中含碳酸钠的质量为x。
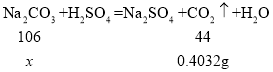
![]()
x≈0.97g;
变质氢氧化钠样品中碳酸钠的质量分数为=![]() 。
。

【题目】某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 g 胆矾,研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
(1)上述实验步骤中需要使用玻璃棒的有____(选填实验序号);步骤①、③中研磨固体所用仪器的名称是_____。
(2)步骤③中洗涤沉淀的操作是_____。
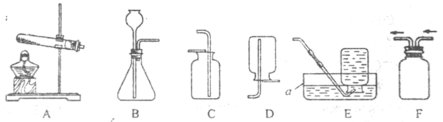
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用如图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
④ | 1.2 g | 无其他物质 | |
⑤ | 1.2 g | CuO 0.5 g | |
⑥ | 1.2 g | MnO2 0.5 g |
(3)上述实验中的“待测数据”指___。
(4)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住A、B之间的乳胶管,拔去干燥管上单孔橡皮塞,______。
(5)为探究CuO在实验⑤中是否起催化作用,还需补做如下两项实验:
a ____(描述操作过程及目的);
b证明CuO的化学性质有没有改变。
【题目】下列实验对应的两种方案设计均不正确的是
选项 | 实验目的 | 实验方案一 | 实验方案二 | ||||||||||||
A | 鉴别碳酸氢钠和碳酸钠两种无色溶液 | 分别取少量溶液分别滴加少量稀硫酸,观察是否有气泡冒出 | 分别取少量溶液,分别滴加几滴无色酚酞溶液,观察溶液是否变红 | ||||||||||||
B | 一定条件下转化
|
|
| ||||||||||||
C | 区分硬水和软水 | 分别向等量水样中加入等量的肥皂水,振荡,观察泡沫的多少 | 分别取等量水样分别滴在玻璃片上,蒸发完毕后,水垢多的为硬水,反之为软水 | ||||||||||||
D | 除去氧气中混有的二氧化碳和水蒸气 | 通过氢氧化钠固体 | 依次通过氢氧化钠溶液和浓硫酸 |
A.AB.BC.CD.D