题目内容
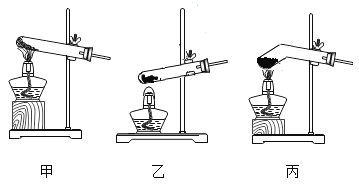
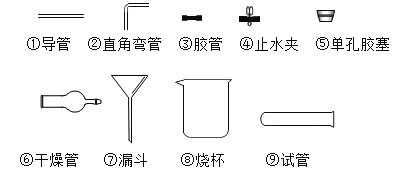
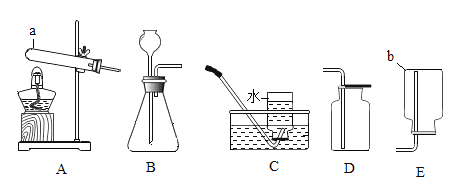
【题目】下图为实验室中常用的几种装置,请回答下列问题。
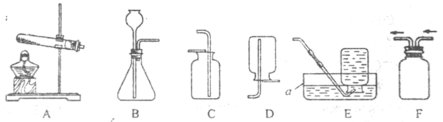
(1)仪器a名称是______。
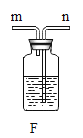
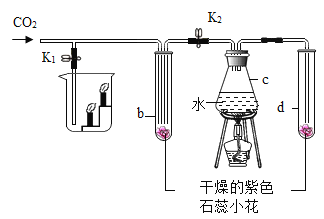
(2)实验室用加热高锰酸钾制取氧气的化学方程式是______,所选用的发生装置是_____(填序号,下同),所选用的收集装置是_____。若用F装置进行“排空气法”收集O2,请把图中的“导气管”补画完整_____。
(3)实验室用稀盐酸和大理石制取二氧化碳时选用的制取装置是____,检验集气瓶中CO2是否已集满的方法是______。
(4)某同学用浓盐酸和大理石制取的CO2能使紫色石蕊溶液变红,对这一现象的合理解释有_____(填序号)。
①产生的CO2直接使石蕊试液变红
②产生的CO2与水反应生成H2CO3使石蕊溶液变红
③浓盐酸挥发出的氯化氢溶于水使石蕊溶液变红
【答案】水槽 ![]() A C或E
A C或E  BC 将燃着的木条放在集气瓶口,若木条立即熄灭,则CO2已集满 ②③
BC 将燃着的木条放在集气瓶口,若木条立即熄灭,则CO2已集满 ②③
【解析】
高锰酸钾加热生成锰酸钾、二氧化锰和氧气,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳和水反应生成碳酸。
(1)仪器a名称是水槽。
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,故实验室用加热高锰酸钾制取氧气的化学方程式是![]() ,反应需要加热,故所选用的发生装置是A,氧气密度比空气大,不易溶于水,用向上排空气法收集或排水法收集,故所选用的收集装置是C或E。若用F装置进行“排空气法”收集O2,氧气要从长管进,空气从短管排出,故“导气管”图为
,反应需要加热,故所选用的发生装置是A,氧气密度比空气大,不易溶于水,用向上排空气法收集或排水法收集,故所选用的收集装置是C或E。若用F装置进行“排空气法”收集O2,氧气要从长管进,空气从短管排出,故“导气管”图为 。
。
(3)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应在常温下进行,故实验室用稀盐酸和大理石制取二氧化碳时选用的制取装置是BC,二氧化碳不燃烧、不支持燃烧,故检验集气瓶中CO2是否已集满的方法是将燃着的木条放在集气瓶口,若木条立即熄灭,则CO2已集满。
(4)二氧化碳和水反应生成碳酸,显酸性,能使紫色石蕊溶液变红,二氧化碳不能使紫色石蕊溶液变红,浓盐酸具有挥发性,挥发出的氯化氢溶于水形成的溶液显酸性,能使紫色石蕊溶液变红,故选②③。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。下列有关硼的说法正确的是( )
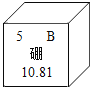
A.相对原子质量为10.81gB.硼元素在化合物中常显+5价
C.原子的核电荷数为5D.原子核外有6个电子
【题目】实验室有一瓶在空气中露置的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行了探究。
(提出问题1)该样品中含有哪些物质?
(提出猜想)通过分析,提出如下猜想:
猜想Ⅰ:该样品中只含Na2CO3;
猜想Ⅱ:该样品中含有NaOH和Na2CO3;
猜想Ⅲ:__________________。
则NaOH变质原因的化学方程式为__________________。
(查阅资料)
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和的碳酸氢钠溶液中几乎不溶解。
(实验探究1)
为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入足量 CaCl2溶液 | ______________ | 证明猜想Ⅲ不成立;该反应的化学方程式为__________ |
(2)将上述反应后的混合液过滤,取滤液加入____________; | 溶液变红 | 证明猜想Ⅱ成立 |
(实验反思)
要除去NaOH中的Na2CO3应选择的化学试剂是_____________。
(提出问题2)如何测量该部分变质样品中碳酸钠的质量分数?
(实验探究2)
小红同学设计如图所示的装置(铁架台略去),实验在27℃,101kPa 下进行,步骤如下:
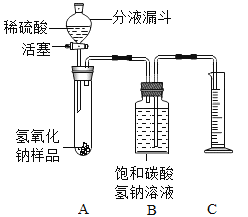
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和的碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和的碳酸氢钠溶液244mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是_______________;
(2)B中集气瓶盛装的饱和的碳酸氢钠溶液不能用水代替,其理由是_______________;
(3)试管中原有的空气对实验结果是否有明显影响?______________(填“有”或“没有”)。
(4)变质氢氧化钠样品中碳酸钠的质量分数为________________。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)